스트론티아나이트에 의한 방해석 치환 예비연구
Copyright ⓒ The Geological Society of Korea 2024
초록
자연계에서 방해석(CaCO3)은 일차 및 이차 광물의 용해-침전 과정(즉, 광물치환)을 통해 금속이온을 보유하는 저장소 역할을 한다. 우리 연구는 산성 스트론튬 용액(초기 pH 2.0-4.5; 10 mM [Sr2+])과 반응하여 방해석이 용해되고 스트론티아나이트(SrCO3)의 침전이 야기되어 광물치환하는 과정을 체계적으로 연구하였다. 산성 용액 내에서 방해석의 용해가 우세하게 발생하며 초기 pH 3.0 이상에서 용해도가 더 낮은 스트론티아나이트가 침전한다. 전자주사현미경 관찰을 통해 스트론티아나이트로 치환된 방해석 결정이 방해석 원래 형태를 유지하는 가상(pseudomorphism)과 치환반응 동안 유체의 유동을 촉진시키는 1 μm 이하 크기 공극의 존재가 확인된다. pH에 따른 방해석 결정의 형상 변화 및 용액의 화학조성 변화는 방해석의 스트론티아나이트에 의한 치환이 기질광물의 용해와 침전광물의 성장 간 화학적인 균형을 통해 발생함을 보여준다.
Abstract
In natural environments, calcite (CaCO3) serves as a major reservoir for various metals through mineral-water interfacial processes in which the dissolution of primary mineral is coupled with the precipitation of secondary mineral. We investigate the reaction of calcite with dissolved Sr2+under acidic conditions (initial pH 2.0-4.5; 10 mM [Sr2+]), where the dissolution of calcite is coupled with the precipitation of strontianite (SrCO3). Our scanning electron microscopy results reveal pseudomorphic replacement of calcite by strontianite along with the presence of sub-micrometer sized pores within the precipitate phase and at the boundary between the substrate and precipitate phases. It is inferred that chemical exchange could be facilitated by such pore space. The evolution of crystal morphologies and solution chemistry, observed as a function of pH, suggests that the replacement of calcite by strontianite occurs through a balance between the dissolution of the primary mineral and the precipitation of the secondary mineral.
Keywords:
calcite (CaCO3), strontianite (SrCO3), mineral replacement, strontium sequestration키워드:
방해석(CaCO3), 스트론티아나이트(SrCO3), 광물치환, 스트론튬 고정화1. 서 론
스트론튬(Sr)은 자연계에서 2가 양이온 상태로 흔하게 나타나는 알칼리 토원소로서 암석, 토양, 석탄, 그리고 석유에서 흔하게 나타난다. 스트론튬은 네 개의 안정 동위 원소(84Sr, 86Sr, 87Sr, 88Sr)와 20 여개의 방사성 동위원소를 지닌다(Friedlander et al., 1981). Sr 방사성 동위원소 중 90Sr은 다른 방사성 동위원소(예. 우라늄)와 비교하여 29.1년의 비교적 긴 반감기를 보이며 핵분열을 통해 많은 양이 생성되기 때문에 방사성 폐기물 관리 관점에서 중요한 동위 원소이다. Sr은 필수 영양소로 사용된다는 보고가 없으나 Sr과 Ca의 유사한 화학적 성질로 인해 Sr을 과다 섭취할 경우 뼈와 치아에 의한 Ca 흡수에 악영향을 끼칠 수 있다(Cohen-Solal, 2002; Nielsen, 2004).
스트론튬 오염은 주로 Sr이 풍부한 광석이나 모암의 풍화 과정에서 자연적으로 발생하는데 반해 인간 활동은 이러한 과정을 가속화하여 Sr이 결합 상태에서 용출되어 먹이 사슬을 통해 인체에 유입될 수 있다(Coudert, 2015). 특히, 90Sr 오염은 자연적으로 발생하는 경우는 거의 없고 방사성 핵폐기물 처리장 인근에서 흔하게 보고되어 왔다. 따라서 자연적 또는 인위적 과정에 의해 배출된 Sr의 토양이나 지하수 내 운송은 생태계 및 지질환경에 중대한 영향을 끼친다. 자연계 및 공학적인 환경 내 Sr의 유동성 관점에서 점토광물이나 금속산화물 등 자연적으로 발생하는 광물과 스트론튬의 상호 작용을 보고한 여러 연구가 있다(Khan and Khan, 1995; Parkman et al., 1998; Missana et al., 2008; Langley et al., 2009). 스트론튬은 광물에 쉽게 흡착되므로 광물과의 상호작용이 천부지권 환경이나 핵폐기물 처리과정에서 스트론튬 운송을 통제할 수 있다.
방해석(CaCO3)은 천부지질 및 해수 환경에서 가장 안정한 탄산칼슘 동질이상체로 나타난다. 방해석은 다양한 금속원소들과 상호작용하여 지하수 및 토양환경 내 금속의 운송 및 거동을 통제할 수 있다. 중성 및 약염기 조건에서 스트론튬 2가 양이온(Sr2+)의 방해석 상 흡착은 pH가 증가함에 따라 증가하는 것으로 나타난다(Zachara et al., 1991). 약염기 및 화학적 평형 조건 아래 낮은 Sr 농도에서는 방해석 표면에서 Sr2+과 Ca2+가 서로 교환된 것으로 나타나며 높은 농도에서는 스트론티아나이트(SrCO3) 침전이 유도되는 것으로 보고된다(Parkman et al., 1998). 이와 같은 기존 연구의 초점은 화학적 평형 또는 방해석의 용해가 제한되는 용액 조건 아래 방해석과 Sr2+간 상호작용에 대한 이해에 집중되어 있다.
최근 우리 연구는 화학적 비평형 조건에서 방해석과 금속의 상호작용이 평형조건에 비해 복잡한 반응과정을 포함할 수 있음을 보였다(Kim et al., 2021; Kim et al., 2023; Kim et al., 2024). 탄산칼슘 광물의 용해와 침전에 대한 화학적 평형 및 비평형은 수용액의 수소이온 농도(pH=-log[H+]로 측정)에 의하여 크게 좌우되며 산성 조건은 용해가 우세한 비평형 조건에 해당한다. 방해석이 산성의 금속(예. Pb2, Cd2+, Zn2+) 용액과 반응할 때 방해석의 용해와 금속 탄산염광물의 침전이 연계되어 용해된 금속의 거동을 크게 좌우한다. 이 연구들의 관찰결과는 한 광물상이 유체와의 접촉을 통해 안정성이 더 높은 새로운 상으로 치환되는 현상(즉, 광물치환)의 주요한 특징(예. 가상, pseudomorphism)을 잘 보여준다(Kim et al., 2023, 2024) 이는 비평형 조건에서의 방해석과 금속이온의 상호작용이 산성광산배수가 배출되는 광미(mine tailing) 지역 등과 같이 중금속 오염이 문제가 되는 지역을 진단하는데 있어 중요할 수 있음을 보여준다.
본 연구는 산성조건(초기 pH 2.0-4.5)에서 방해석과 Sr2+의 상호작용에 대해 체계적으로 이해하는 첫 연구이다. 산성용액 조건에서 방해석이 용해되고 Sr2+의 침전상인 스트론티아나이트(SrCO3)가 형성되는 것이 관찰된다. 결과로 발생하는 스트론티아나이트에 의한 방해석 치환은 두 탄산염 광물의 용해도 차이에 기인한다(KSP, calcite = aCa2+·aCO32- = 10-8.48, KSP, strontianite = aSr2+·aCO32- = 10-9.27; Ball and Nordstrom (1991)). 초기 pH 별로 용해되는 방해석과 성장하는 스트론티아나이트의 형상을 분석하였으며 이를 용액의 화학조성 변화 자료과 함께 결합해 용해-침전 간 균형의 관점에서 스트론티아나이트에 의한 방해석 치환을 진단하였다.
2. 연구방법
2.1. 시약 및 실험과정
방해석 시료(중국 허난성)는 분쇄 후 체질을 통해 크기별로 분급하고 47-53 μm 크기 입자를 사용하여 실험을 진행하였다. 해당 방해석 입자들은 산성 Sr2+ 용액과 반응시켜 실험을 진행하였다. 실험에 사용된 모든 Sr2+ 용액은 3차 증류수(resistivity ≥ 18.2 MΩ·cm; TOC < 5 ppb) 용매에 염화 스트론튬 6 수화물(SrCl2·6H2O, Sigma Aldrich; purity of ≥ 99%)을 녹여 준비한 후 짙은 HCl이나 NaOH 용액을 넣어 원하는 pH로 조정되었다.
광물치환 실험은 50-100 mL Sr2+ 용액 내에 1 g CaCO3(s)/1L 용액 비율을 유지하여 대기와의 접촉 없이 밀폐된 용기 내에서 진행하였다. 용액의 초기 pH는 2.0-4.5 사이로 설정되었으며 Sr2+ 농도는 10 mM로 고정하여 진행하였다. 반응은 16-24시간 동안 교반을 통해 진행하였다. 이와 같은 실험 조건은 해당 용액에서 방해석이 용해되어 탄산염 농도가 증가할 경우 포화되어 침전되는 스트론티아나이트의 형상을 관찰할 수 있는 조건으로 설정되었다. 용액 내 용존된 Sr2+의 농도가 방해석과 상호작용을 통해 용액에서 제거된 비율을 저감률(R)로 정의하였다:
Ci와 Cr은 각각 초기 및 반응 후 Sr2+ 농도이며 유도 결합 플라즈마 분광분석법(ICP-OES)을 통하여 분석하였다.
2.2. 광물상 및 형상 분석
X-선 회절 패턴은 Rigaku Ultima IV 회절기를 사용하여 40 kV와 30 mA 조건에서 얻었다. 스텝당 0.3초 동안 0.02° 2θ 크기로 Cu Kα ((λ = 0.15418) 방사광을 사용해 측정하였다. 반응 전후 결정의 형상은 Phenom 전자주사현미경(scanning electron microscopy, SEM)을 사용하여 촬영하였다.
3. 결 과
3.1. 방해석과 산성 Sr2+ 용액 반응상 스트론티아나이트 형성
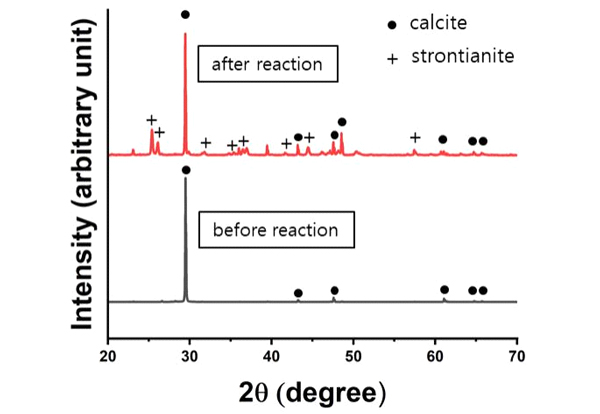
반응 전과 후 고체시료의 광물상은 X-선 회절 분석을 통해 확인하였다. 반응 전 시료는 방해석의 X-선 회절 패턴과 잘 일치한다. 초기 pH 3.0에서 10 mM [Sr] 용액과 16시간동안 반응한 시료에서 스트론티아나이트에 해당하는 피크가 방해석 피크와 함께 관찰되었다(그림 1). 산성 Sr2+ 용액 내에서 방해석이 용해되고 스트론티아나이트가 형성되었음을 보여준다. 우리 실험 조건에서 관찰되는 용해-침전과정이 보이는 광물치환의 특징은 세션 4.1에서 자세히 논의한다.
3.2. 광물치환 동안 pH 변화와 Sr2+ 및 Ca2+ 농도 변화
방해석이 산성 Sr2+ 용액(10 mM [Sr]; 초기 pH 3.0)과 반응하는 동안 pH 변화를 반응 시간에 따라 측정하였다(그림 2). 처음 1시간 이내에 pH 7.8까지 급증하다가 약간의 pH 감소 후 최종 24시간까지 pH 7.6으로 유지되었다. 용존 Sr2+이 없는 산성용액과 반응한 경우(0 mM [Sr]; 초기 pH 3.0), 처음 3시간 동안 pH 8.2로 가파르게 증가한 후 pH 8.3으로 일정하게 유지되었다(그림 2).

pH variation with time during reaction with acidic Sr2+-containing solution (initial pH 3.0; [Sr2+] = 10 mM).
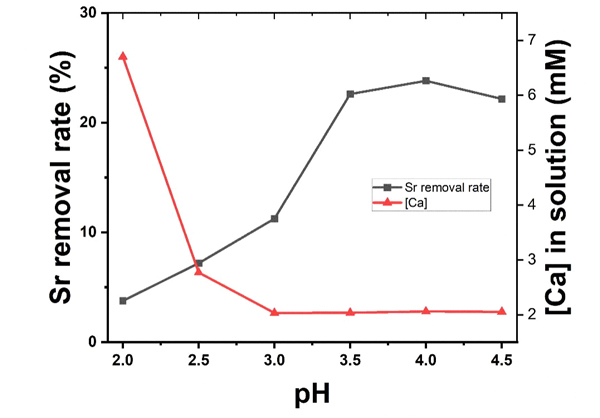
그림 3에는 산성 Sr2+ 용액과 방해석이 반응한 후 Sr2+ 저감률과 용액 내 Ca2+ 농도를 초기 pH 별로 도시하였다. Sr2+ 저감률은 초기 pH 2.0인 용액에서 약 4%로 나타났으며 pH 3.5까지 23%로 서서히 증가하였다. pH 3.5에서 4.5 사이의 범위에서 약 24%로 거의 일정한 저감률을 보였다. 초기 pH 2.0인 용액과 방해석이 반응한 경우, [Ca2+]는 6.7 mM로 나타나며 pH 3.0으로 증가함에 따라 2.0 mM까지 감소하고 pH 4.5까지 약 2.1 mM로 거의 일정하게 유지되었다. 초기 pH 2.0인 용액에서 Ca2+ 농도가 상대적으로 높게 나타나는 것은 용액 내에서 방해석 용해가 Sr2+침전에 비해 우세하게 나타나는 것에 기인한다.
3.3. 방해석과 스트론티아나이트 포화지수 계산
치환실험에서 관찰되는 pH 범위에서 방해석과 스트론티아나이트의 포화지수를 계산하였다(그림 4). 방해석과 스트론티아나이트의 포화도(saturation index, SI)는 다음 식으로 정의된다:
| (1) |
| (2) |
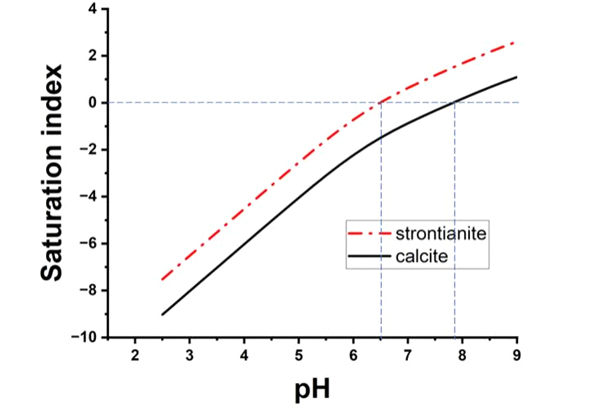
Saturation index of strontianite and calcite as a function of pH. The calculations were performed using Visual MINTEQ software with thermo database, for a solution containing 10 mM SrCl2 equilibrated with 0.08 g/L CaCO3(S) (= 2 mM CaCO3(s)).
a는 이온활동도이며, Ksp는 침전하는 탄산염광물의 열역학적 용해도곱을 나타낸다.
10 mM [Sr2+]와 calcite의 평형조건에서 계산된 포화도는 방해석과 스트론티아나이트 모두에 대해 pH가 증가함에 따라 증가한다.
24시간 반응한 용액의 최종 pH는 7.6으로 측정되었다. 해당 용액 조건에서 SIstrontianite와 SIcalcite는 각각 1.27과 -0.23으로 계산되었다. 이는 광물치환이 진행되는 동안 스트론티아나이트에 대해서는 과포화이고 방해석에 대해서는 불포화인 조건이었음을 지시한다.
3.4. 용해 및 치환된 방해석의 형상
반응이 진행되기 전과 후 방해석의 형상을 SEM 촬영을 통해 분석하였다(그림 5). 반응 전 방해석 결정은 각진 형태로 나타나며 입자의 외부 형상에서 편평한 (104) 면이 우세하게 관찰되었다(그림 5a). 초기 pH 2.0인 Sr2+ 용액과 반응한 방해석 입자는 모서리와 가장자리가 용해되어 둥근 형태가 발달한 입자들이 관찰되었다(그림 5b). 스트론티아나이트 형성은 초기 pH 3.0 이상의 용액과 방해석이 반응한 경우에 관찰되었다. 초기 pH 3.0 조건에서 스트론티아나이트가 방해석의 표면을 부분적으로 덮고 있는 것이 확인되었다(그림 5c). 초기 pH 4.5에서 반응이 진행된 경우 방해석의 각진 형태가 유지되면서 외부 표면은 스트론티아나이트로 치환된 형태를 관찰할 수 있었다(그림 5d). 형성된 스트론티아나이트 입자는 1 μm 이하 크기의 입자들이 표면을 촘촘히 덥고 있는 방식으로 성장하였으며 입자와 입자 사이에 공극이 관찰되기도 하였다. 스트론티아나이트의 성장은 방해석 원형을 전반적으로 유지하며 진행된 것으로 관찰되었다.
4. 토 론
4.1. 용해와 침전과정의 균형
SEM에서 관측되는 외부 형상에서 스트론티아나이트 입자들 사이에 공극과 스트론티아나이트와 방해석 경계 사이에 공극이 관찰되었다(그림 5c와 d). 반응된 결정에서 관찰되는 공극의 존재는 벌크 용액(bulk solution)이 공극을 통해 유입되어 공극 용액(pore solution)과 교환되면 스트론티아나이트 침전이 시작된 이후에 H+와 Sr2+ 이온이 공극 내로 유입되어 침전상의 성장이 기질광물을 치환하며 결정 내부를 향해 진행될 수 있었음을 지시한다. 또한, 용해-침전 반응이 공극 내에서 서로 연계(coupling)되어 균형을 유지하며 진행되는 과정은 방해석 표면 전체가 스트론티아나이트로 치환된 입자(그림 5d)가 (104) 면이 특징적인 방해석 원래 형태(그림 5a)를 전반적으로 유지하는 가상 현상을 잘 설명한다(Putnis, 2002, 2009).
광물의 용해-침전 간 균형 및 불균형은 pH에 따른 Sr 및 Ca 농도 변화에서도 확인된다(그림 3). 초기 pH 2.0-3.0에서는 용액 내 Ca 농도가 저감된 Sr 농도에 비해 높게 유지된다. 이는 방해석 용해가 스트론티아나이트 침전보다 우세하게 발생했기 때문으로 판단된다. pH 3.5-4.5에서는 용액 내 Ca농도와 용액에서 제거된 Sr 농도가 각각 2.0-2.4 mM 범위내에서 일정하게 유지된다. 이 조건에서는 방해석이 용해된 몰수와 유사한 몰수만큼 스트론티아나이트 침전이 발생하여 용해-침전 간 균형이 유지되었을 것으로 판단된다.
방해석과 Sr2+ 용액 간 반응 상에서 시간에 따른 pH변화(그림 2)는 방해석과 스트론티아나이트의 용해 및 침전간 균형 및 불균형의 시간에 따른 변화를 간접적으로 지시한다. 산성 Sr2+ 용액(10 mM [Sr]; 초기 pH 3.0)과 방해석의 반응에서 초기 30분 동안 pH 6.8로 가파르게 증가한 후 1시간 후에 pH 7.8까지 증가하였다. 이와 같은 pH 변화는 방해석과 스트론티아나이트의 포화도를 결정한다(그림 4). 반응 30분 이전에는 방해석과 스트론티아나이트 모두 불포화 상태여서 방해석의 용해가 우세하고 스트론티아나이트의 침전은 일어나지 않았을 것으로 보인다. 30분에서 1시간 사이에는 방해석에 대해 불포화이고 스트론티아나이트에 대해 과포화 조건이며 광물치환이 우세하게 진행되었을 것으로 추측된다. 이후 pH가 7.6으로 약간 감소하고 유지되는 구간은 방해석에 대해 포화 조건에 가까워 방해석의 용해가 제한되고 스트론티아나이트에 의한 치환이 느려지거나 거의 정지된 상태였을 것으로 추정된다. 스트론티아나이트에 의한 방해석 치환의 시간에 따른 진화는 추후 SEM 촬영 및 ICP-OES 분석을 추가로 진행하여 상세히 연구할 예정이다.
4.2. 산성용액 내 Sr 고정화 메커니즘의 진화
초기 pH 2.0 용액과 방해석의 반응에서는 약 4%의 낮은 Sr 저감율을 보이는데(그림 3) 이는 SEM 결과에서 탄산염 광물치환이 거의 진행되지 않은 것과 일치한다(그림 5b). 해당 용액조건에서는 방해석과 스트론티아나이트 모두 불포화 상태(그림 4)로 존재하기 때문에 방해석이 용해되어 발생하는 용존 탄산염 농도의 증가가 스트론티아나이트의 침전을 야기하지 않는 것으로 판단된다. 초기 pH 3.0 용액 조건에서 방해석 표면이 부분적으로 스트론티아나이트에 의해 치환된 형태로 확인되며 초기 pH 4.5 조건에서는 방해석 입자의 표면이 전체적으로 스트론티아나이트로 덮인 것을 확인할 수 있었다(그림 5d). 형상관찰 결과는 용액 pH가 증가함에 따라 Sr 저감 메커니즘이 표면 흡착에서 용해 및 침전 과정으로 진화했을 가능성을 지시한다.
5. 결 론
본 연구는 산성 용액 내 방해석 용해가 발생하는 화학적 비평형 조건에서 스트론티아나이트가 성장하여 용존된 Sr2+가 방해석 상에 고정화되는 과정에 대해 체계적인 연구를 수행하였다. 초기 pH 조건에 따른 반응한 방해석 결정의 형상변화 및 용액의 화학조성 변화는 스트론티아나이트에 의한 방해석 치환이 일차광물의 용해와 이차 광물의 침전 간의 균형에 의해 결정되는 것을 입증한다. 본 연구결과는 산성 유체형태로 발생하는 고준위 방사능폐기물의 처리과정이나 폐기물 유출로 인한 주변 토양 및 지하수 환경의 오염의 자연적 정화 및 공학적 복원과정에서 방해석과 Sr2+의 상호작용이 중요한 역할을 할 수 있을 것으로 판단된다. 또한 산성조건이 우세한 지질환경(예, 산성광산배수)에서 탄산염암과 용존된 금속이온 간의 반응이 용해-침전 연계에 의한 광물치환에 의해 진행될 수 있다는 점을 시사한다.
본 연구에서 전자주사현미경을 이용한 형상변화 관찰은 광물치환이 일어나는 동안 유체의 교환을 가능하게 하는 공극의 존재를 확인할 수 있었다. 하지만 전자주사현미경은 외부형상을 관찰하는데 유용하지만 결정 내 내부구조를 관찰하기에는 한계를 보였다. 방해석과 스트론티아나이트 간 계면 및 공극의 공간적 분포 등 치환된 결정의 내부구조를 확인하기 위해서는 싱크로트론 X-선을 이용한 나노-단위 단층촬영과 같은 고해상도 분석이 필요할 것으로 판단된다(Kim et al., 2023, 2024). 또한 추후 연구에서는 초기 pH의 변화에 따른 스트론튬 저감 메커니즘의 전환 가능성을 입증하기 위해 X-선 흡수 미세구조 분석을 사용한 원자·분자 단위의 미시적 증거를 수집해야 할 것으로 판단된다.
Acknowledgments
이 논문은 2024년도 정부(교육부)의 재원으로 한국연구재단의 G-램프(LAMP) 사업 지원을 받아 수행된 연구임(No. RS-2023-00301702).
References
-
Ball, J.W. and Nordstrom, D.K., 1991, User's manual for WATEQ4F, with revised thermodynamic data base and text cases for calculating speciation of major, trace, and redox elements in natural waters. US Geological Survey.
[https://doi.org/10.3133/ofr91183]

-
Cohen-Solal, M., 2002, Strontium overload and toxicity: impact on renal osteodystrophy. Nephrology Dialysis Transplantation, 17, 30-34.
[https://doi.org/10.1093/ndt/17.suppl_2.30]

-
Coudert, F.-X., 2015, Strontium's scarlet sparkles. Nature chemistry, 7, 940-940.
[https://doi.org/10.1038/nchem.2376]

- Friedlander, G., Kennedy, J.W., Macias, E.S. and Miller, J.M., 1981, Nuclear and radiochemistry. John Wiley & Sons.
-
Khan, S.A. and Khan, M.A., 1995, Sorption of strontium on bentonite. Waste Management, 15, 641-650.
[https://doi.org/10.1016/0956-053X(96)00049-9]

-
Kim, Y., Abdilla, B., Yuan, K., De Andrade, V., Sturchio, N.C., Lee, S.S. and Fenter, P., 2021, Replacement of calcium carbonate polymorphs by cerussite. ACS Earth and Space Chemistry, 5, 2433-2441.
[https://doi.org/10.1021/acsearthspacechem.1c00177]

-
Kim, Y., Lee, S.S., Abdilla, B., Nikitin, V., Sturchio, N.C. and Fenter, P., 2024, Formation of zinc carbonate phases on dissolving calcite, aragonite, and vaterite in acidic aqueous solutions. Geochimica et Cosmochimica Acta, 380, 131-139.
[https://doi.org/10.1016/j.gca.2024.06.034]

-
Kim, Y., Tekawade, A., Lee, S.S. and Fenter, P., 2023, Morphological and crystallographic controls in the replacement of calcite and aragonite by cerussite and otavite. Geochimica et Cosmochimica Acta, 341, 16-27.
[https://doi.org/10.1016/j.gca.2022.11.010]

-
Langley, S., Gault, A.G., Ibrahim, A., Takahashi, Y., Renaud, R., Fortin, D., Clark, I.D. and Ferris, F.G., 2009, Sorption of strontium onto bacteriogenic iron oxides. Environmental science & technology, 43, 1008-1014.
[https://doi.org/10.1021/es802027f]

-
Missana, T., Garcia-Gutierrez, M. and Alonso, U., 2008, Sorption of strontium onto illite/smectite mixed clays. Physics and Chemistry of the Earth, Parts A/B/C, 33, S156-S162.
[https://doi.org/10.1016/j.pce.2008.10.020]

-
Myszka, B., Schüßler, M., Hurle, K., Demmert, B., Detsch, R., Boccaccini, A.R. and Wolf, S.E., 2019, Phase-specific bioactivity and altered Ostwald ripening pathways of calcium carbonate polymorphs in simulated body fluid. RSC advances, 9, 18232-18244.
[https://doi.org/10.1039/C9RA01473J]

-
Nielsen, S.P., 2004, The biological role of strontium. Bone, 35, 583-588.
[https://doi.org/10.1016/j.bone.2004.04.026]

-
Parkman, R., Charnock, J., Livens, F. and Vaughan, D., 1998, A study of the interaction of strontium ions in aqueous solution with the surfaces of calcite and kaolinite. Geochimica et Cosmochimica Acta, 62, 1481-1492.
[https://doi.org/10.1016/S0016-7037(98)00072-6]

-
Putnis, A., 2002, Mineral replacement reactions: from macroscopic observations to microscopic mechanisms. Mineralogical Magazine, 66, 689-708.
[https://doi.org/10.1180/0026461026650056]

-
Putnis, A., 2009, Mineral replacement reactions. Reviews in mineralogy and geochemistry, 70, 87-124.
[https://doi.org/10.2138/rmg.2009.70.3]

-
Zachara, J., Cowan, C. and Resch, C., 1991, Sorption of divalent metals on calcite. Geochimica et cosmochimica acta, 55, 1549-1562.
[https://doi.org/10.1016/0016-7037(91)90127-Q]