저온환경에서 생지화학 반응에 따른 칼륨 동위원소 분별
초록
최근 분석기술 및 질량분석기의 발달로 비전통 안정동위원소 연구가 활발하게 이루어지고 있지만, 전 세계적으로 칼륨 동위원소를 활용한 연구는 아직 미비한 실정이다. 칼륨은 대륙지각(2.3 wt.%), 해양지각(0.16 wt.%), 해수(400 ppm) 내 주요 원소로 존재하며, 식물의 영양 원소 중 하나이다. 지각 내 칼륨은 주로 규산염 광물에 존재하며 용존 칼륨의 90% 이상이 규산염 광물의 풍화에 기인한다. 질량수 39와 41을 갖는 칼륨 안정동위원소 비는 고온의 마그마 분화과정 중 분별이 일어나지 않지만(α= ±0.07‰, 2sd) 저온 환경에서는 상대적으로 높은 분별이 일어난다(α= ±~1.3‰, 2sd). 따라서 칼륨 동위원소는 규산염 풍화, 과거 기후와 환경을 이해하는 지시자로 활용될 수 있다. 이 논평에서는 칼륨 동위원소 특성, 분석법 및 지표환경에서 칼륨 동위원소 분별을 일으키는 요인(일차광물 용해, 이차광물 생성 및 식물 섭취)에 대해 소개하고자 한다.
Abstract
Although a recent development of mass spectrometers, such as multi-collector inductively coupled mass spectrometer (MC-ICP-MS), has led to non-traditional stable isotopes in earth and environmental sciences, potassium (K) isotopes are still in the incipient stage yet. Potassium is a major element in continental crust (2.3 wt.%), oceanic crust (0.16 wt.%), and seawater (400 ppm), and is one of major nutrients in the plants. Potassium in the crust mostly exists in silicate minerals and therefore, over 90% of riverine K is derived from silicate weathering. Although the fractionation of K isotopes with mass 39 and 41 is little during high-temperature magmatic differentiation (α= ±0.07‰, 2sd), it is significant during low-temperature processes, up to ±1.3‰ (2sd). Therefore K isotopes can be used as a tracer for understanding silicate weathering, paleo-climate and paleo-environment. This review introduces the characteristics of K isotopes, the analytical methods, and the major factors causing K isotope fractionation in the surface environments, such as primary mineral dissolution, secondary mineral formation and plant uptake.
Keywords:
potassium isotope, isotope fractionation, surficial process키워드:
칼륨 동위원소, 동위원소 분별, 지표환경1. 서 론
규산염 광물의 화학적 풍화는 백만년 단위의 지질시대 규모에서 대기의 이산화탄소 농도와 전 지구적 탄소순환을 조절하는 역할을 한다(Berner, 1999). 지질 시대에 걸친 규산염 풍화를 이해하기 위해 주로 스트론튬 동위원소 비(87Sr/86Sr), 오스뮴 동위원소 비(187Os/188Os), 리튬 동위원소(δ7Li)가 사용되었다(Li et al., 2019a). 그러나 4000만년 전 신생대 해양 내 87Sr/86Sr 비 증가는 지각 융기에 따른 풍화율 증가(Raymo et al., 1988)가 아닌 화강암 내 산재된 변질 받은 방해석 용해에 의한 것으로 밝혀졌다(Blum et al., 1998; Jacobson and Blum, 2000). 또한 신생대 동안 해양 내 187Os/188Os 비의 증가(Pegram et al., 1992)는 대륙 풍화의 영향보다는 무산소 해양 퇴적물(anoxic marine sediments) 내 유기물 흐름(Ravizza and Esser, 1993; Peucker-Ehrenbrink and Ravizza, 2000)이나 황철석 용해(Torres et al., 2014)에 기인하는 것으로 알려졌다. 마지막으로 쇄설성 퇴적물의 δ7Li 값은 풍화 강도(weathering intensity)의 지시자로 사용할 수 있지만 전 지구적 특성이 아닌 지역적 특성(Peizhen et al., 2001)을 반영하는 한계가 있다.
칼륨(K)은 원자번호가 19인 알칼리 금속 원소로 지구상 물질 내 주요 원소로 존재한다; 맨틀 내 190-260 ppm (Lyubetskaya and Korenaga, 2007; Palme and O’Neill, 2014), 대륙지각 내 2.3 wt.% (Rudnick, 2014), 해양지각 내 0.16 wt.% (White and Klein, 2014), 해수 내 400 ppm (Culkin and Cox, 1966; Riley and Tongudai, 1967), 강물 내 0.2-20 ppm (Meybeck, 2003). 강의 용존 K의 약 90% 정도는 규산질 암석의 풍화에서 유래하며(Meybeck, 1987; Berner and Berner, 2012), 해양에서 체류 시간(residence time)은 약 7백만년이다(Li, 1982). 칼륨은 2개의 안정 동위원소(39K, 41K)와 1개의 방사성 동위원소(40K)를 갖으며 자연계에서 이들의 존재비는 각각 93.2581%, 6.7302%, 0.0117% 이다(Berglund and Wieser, 2011). 이때, 39K과 41K의 질량차는 5.13%이고 40K은 1.25×109년의 반감기를 갖고 음의 베타붕괴(β−)를 통해 40Ca (88.8%)과 양의 베타붕괴(β+) 또는 전자(ε)포획을 통해 40Ar (11.2%)으로 붕괴된다(Faure and Mensing, 1986; Li et al., 2019c). 열 이온화 질량분석기(thermal ionization mass spectrometer)와 이차 이온 질량분석기(secondary ionization mass spectrometer)를 이용한 K 동위원소(δ41/39K; 이후 δ41K)의 분석정밀도는 각각 ±1‰ (Barnes et al., 1973; Garner et al., 1975)과 ±0.5‰ (Humayun and Clayton, 1995; Humayun and Koeberl, 2004)로 달의 토양과 같은 고온 환경에서 증발이나 응축으로 발생하는 8‰ 이상의 동위원소 분별을 해석하는데 문제가 없었지만 저온환경에서 발생하는 작은 분별(<1‰)을 구분할 수 없었다(Li et al., 2016).
최근 분석기술과 고분해능 다검출기 유도결합 플라즈마 질량분석기(multi-collector inductively coupled plasma mass spectrometer; MC-ICP-MS)의 발달로 초정밀 K 동위원소 분석(δ41K = ±0.05‰, 2σ)이 가능해져 지질학 분야에서 새로운 동위원소 지시자로 그 가능성이 커지고 있다(Li et al, 2019c and references therein). 고온의 마그마 분화과정에서 생성된 현무암과 유문암은 제한된 δ41K (-0.53 ~ -0.41‰; Tuller-Ross et al., 2019b)을 갖지만 해수, 강, 이차광물 및 식물체는 벌크 규산염(bulk silicate earth; BSE; δ41K = -0.48‰; Wang and Jacobsen, 2016) 대비 넓은 δ41K (-1.67 ~ +1.15‰; Christensen et al., 2018; Li et al., 2021c)을 갖는다. 따라서 지표 환경에서의 생지구화학 반응에 의한 K 동위원소 분별을 통해 규산염의 화학적 풍화와 이에 따른 탄소순환을 이해하는 유용한 프록시의 가능성이 제안되었다(Li et al., 2019b).
이 논평에서는 MC-ICP-MS를 활용한 K 동위원소 분석법과 지표환경에서 주요 K 동위원소 분별 요인에 대해 소개하였다.
2. K 동위원소 분석법
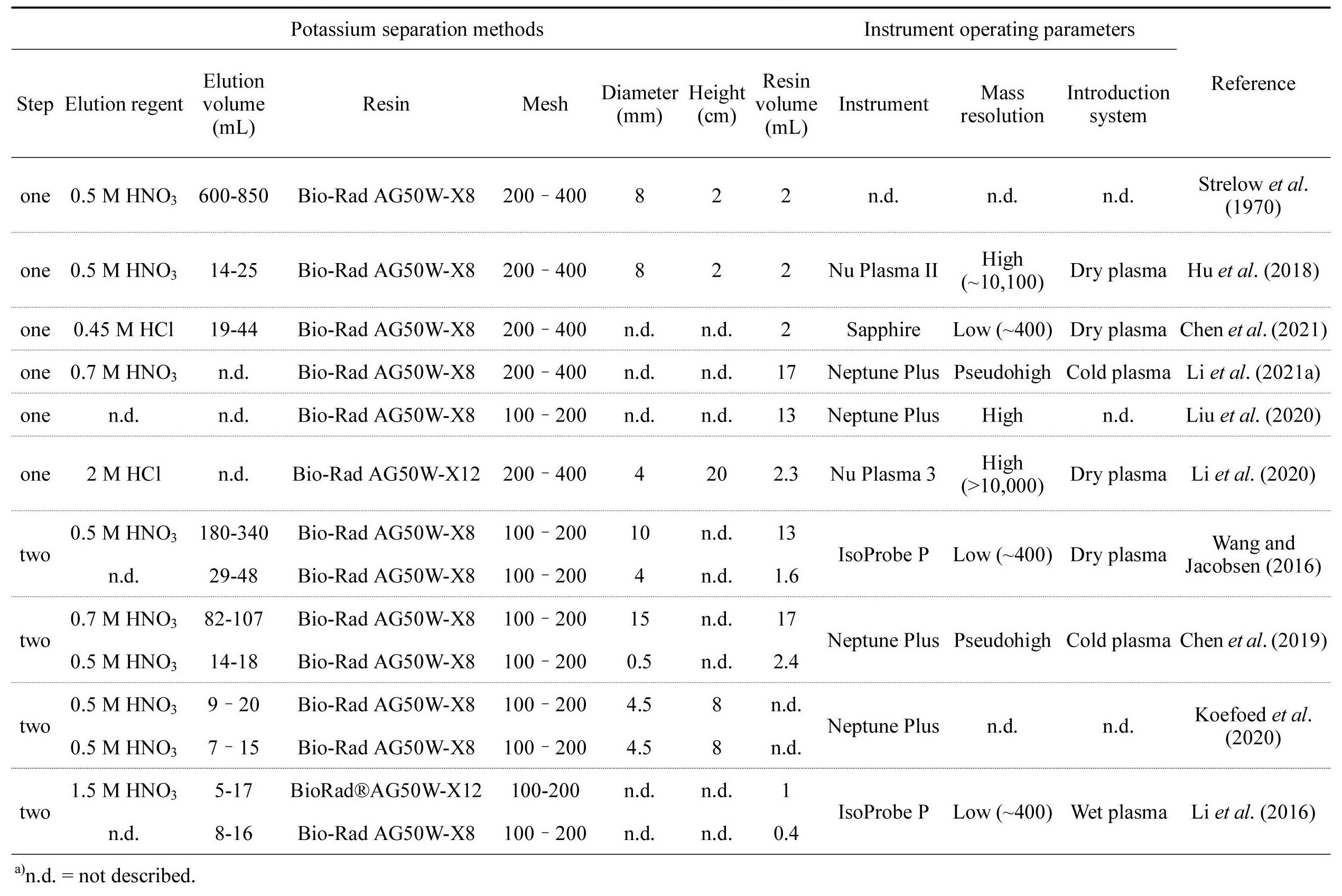
Strelow et al. (1970)이 처음으로 양이온 교환수지(AG50W-X8, 200-400 mesh)와 질산을 이용해 규산질 암석 표준시료인 DTS-1 (더나이트; dunite)와 PCC‐1 (감람암; peridotite)의 K 분리법을 보고한 이후, 다양한 산과 양이온 교환수지를 이용한 분리법이 발표되었다(표 1). 또한, MC-ICP-MS를 이용하여 K 동위원소 분석시, 아르곤 수소화물(38Ar1H+ 및 40Ar1H+)과 40Ar+에 의한 동종 질량 간섭을 최소화하기 위하여 저온 플라즈마 기법이나 충돌셀 기술을 사용하여 0.3‰ 수준의 외부 정밀도가 보고되었다(Wang and Jaconbsen, 2016 and references therein). 최근 고분해능 MC-ICP-MS의 발달로 인해 고분해능(M/ΔM = ~4887; Hu et al., 2018) 모드에서 0.1‰ 이하의 내부 정밀도를 갖는 초정밀 K 동위원소 분석이 가능해졌다. 칼륨 동위원소 분석시 장비에서 발생할 수 있는 기기 질량편이(instrumental mass bias)를 보정하기 위하여 동위원소 표준물질을 이용해 표준물질-시료-표준물질의 외부 보정법(standard-sample bracketing method)을 이용한다. 분석된 K 동위원소 비는 표준물질에 대한 델타표기법(δ-notation)으로 다음과 같이 보고한다.
| (1) |
과거 K 동위원소 표준물질로 NIST SRM 985가 사용되었지만(Garner et al., 1975), 최근에는 NIST SRM 3141a (KNO3), SRM 999b, SRM 999c (KCl) 및 Suprapur KNO3 (99.995%) 등이 주로 사용된다. Chen et al. (2019)은 NIST SRM 3141a와 Suprapur KNO3 (99.995%)의 K 동위원소 비가 분석오차 내에서 동일함을 보고하였다(Δ41K = 0.00±0.04‰; 2sd).
3. K 동위원소 분별 요인
39K와 41K 두 동위원소 간 5% 이상의 큰 질량차로 인하여 자연계에서 상당한 동위원소 분별이 발생할 수 있고, 현재까지 보고된 지구상의 주요 물질의 δ41K의 차이는 ~2.82‰로 그림 1과 같다. 벌크 규산염(BSE)과 해수 간 ~0.6‰ 차이(Morgan et al., 2018; Chen et al., 2020)는 저온환경에서 생지화학적 반응에 의한 동위원소 분별을 지시하며, 이 장에서는 동위원소 분별을 일으키는 주요 요인들: 1) 일차광물 용해(primary mineral dissolution), 2) 이차광물 생성(secondary mineral formation) 및 3) 식물섭취(plant uptake)에 의한 동위원소의 분별 정도와 기작에 대해서 소개한다. 이를 통하여 지구상 물질의 K 동위원소 차이를 이해하고, 향후 다양한 분야에 K 동위원소를 적용할 수 있는 기틀을 제공하고자 한다.
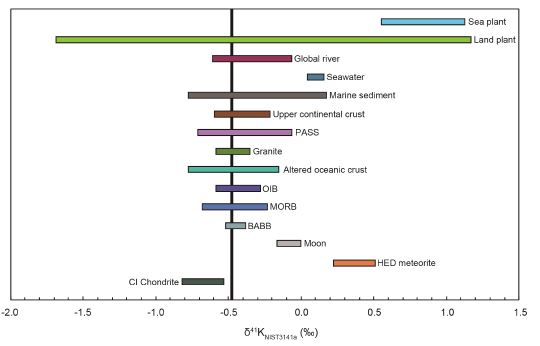
Plot of δ41K (‰) values of different geochemical reservoirs, major extraterrestrial and terrestrial reservoirs, relative to NIST 3141a. The vertical line represents the average K isotopic composition of bulk silicate earth (δ41K = -0.48‰; Wang and Jacobsen, 2016). Potassium isotopic data are from literatures: CI chondrites and HED (howardite–eucrite–diogenite) meteorites (Tian et al., 2019); Moon (Tian et al., 2020), BABBs (back-arc basin basalts), MORBs (mid-ocean ridge basalts), and OIBs (oceanic island basalts; Tuller-Ross et al., 2019a); altered oceanic crust (Liu et al., 2021); granite (Huang et al., 2020); PAAS (post-Archean Australian shale) and upper continental crust (Li et al., 2019b; Huang et al., 2020); marine sediments (Santiago Ramos et al., 2020); seawater (Li et al., 2016; Hu et al., 2018); global river (Li et al., 2019a; Wang et al., 2021); land plants (Li et al., 2016, 2021c; Li, 2017; Christensen et al., 2018) and sea plants (Li et al., 2017).
3.1 일차광물 용해(primary mineral dissolution)
칼륨은 주로 장석(feldspar)의 팔면체 구조, 백운모(muscovite)나 흑운모(biotite)의 층간에 존재하며(Xue et al., 2019), K+은 Li+과 같이 광물 표면이나 층간 흡착력보다 물에서의 화학결합(bond)이 더 강한데(Glendening and Feller, 1995) 물-광물의 반응(water-mineral interaction) 과정 중 K 동위원소의 분별 방향에 대해서는 잘 알려지지 않았다(Chen et al., 2020).
Li et al. (2021a)은 무기산(질산) 및 유기산(시트르산 및 옥살산)을 이용하여 화강섬록암(GSP-2; Colorado granodiorite)과 현무암(BHVO-2; Hawaiian basalt) 용해 실험을 진행하였다. 반응 후 24시간 이내에 가벼운 K 동위원소가 빠르게 용출되어 반응 용액과 암석 간 K 동위원소 차이(Δ41Kliquid-solid)가 최대 -1.01‰이었으며, 점차 평형상태로 도달하였다. 반응 초기 가벼운 동위원소가 용액으로 빠르게 방출된 것은 확산(diffusion)과 이온 용매화(ion solvation)에 의해 교란된 운동학적 동위원소 효과(kinetic isotope effect)에 기인하며, 평형상태 이후 완전 용해에 의한 마스킹 효과(masking effect)와 41K이 풍부한 표층 용해에 의해 동위원소 분별이 나타나지 않음을 제안하였다. 또한, 시간에 따라 화강암과 현무암의 K 동위원소 분별 패턴이 유사하게 나타나는데 K이 풍부한 장석이나 운모류 같은 광물의 함량이 K 동위원소 분별 정도에 영향을 미치지 않는다고 제시하였다.
3.2 이차광물 생성(secondary mineral formation)
화학적 풍화를 겪은 기반암의 δ41K는 -0.69 ~ -0.08‰ (Li et al., 2019b)의 범위를 갖고, 강은 -0.38±0.04‰ (Wang et al., 2021)로 벌크 규산염(δ41KBSE = -0.48‰)과 차이를 보인다. 이는 규산염 광물의 화학적 풍화 중 생성된 이차광물이 가벼운 K 동위원소(39K)를 선택적으로 취하며 무거운 K 동위원소(41K)는 강물로 용출됨을 지시한다(Li, S. et al., 2019a; Li, W. et al., 2019b; Chen et al., 2020; Huang et al., 2020; Teng et al., 2020; Wang et al., 2021).
Teng et al. (2020)은 K 장석(K-feldspar)이 풍부한 화강암의 풍화층 연구를 통해 K 장석의 조화 용해(congruent dissolution)는 화강암의 화학적 풍화를 조절한다고 보고하였다. K 장석은 화학적 풍화를 통해 먼저 일라이트로, 이후 일라이트는 고령석(kaolinite)으로 변질된다:
a) 3KAlSi3O8 + 2H+ + 12H2O
= KAl3Si3O10(OH)2 + 6H4SiO4 + 2K+
b) 2KAl3Si3O10(OH)2 + 2H+ + 3H2O
= 3Al2Si2O5(OH)4 + 2K+
위의 풍화 과정에서 K 동위원소 분별은 (1) 용존 K+와 K 함유 광물 간, (2) 서로 다른 광물 간, 그리고/또는 (3) 고령석에 흡착된 K와 일라이트 광물 내 K 사이에서 일어날 수 있다. 특히 동위원소 분별 기작 (3)은 마그네슘, 구리 및 아연 같은 일부 안정동위원소 시스템에서도 큰 동위원소 분별을 일으키지만(Moynier et al., 2017; Teng et al., 2017), 이 지역의 화강암 풍화토(saprolite)에는 고령석보다 K 장석과 일라이트가 더 풍부하기 때문에 분별 기작 (3) 보다는 (1)과 (2)로 인해 K 동위원소 분별이 일어나는 것으로 보았다. 또한, 화강암 풍화토 내 K 장석과 일라이트간 δ41K 차이(Δ41KKsp-illite)는 약 -0.3‰로, 이는 풍화 과정 중 무거운 동위원소가 선택적으로 용출되고 가벼운 동위원소는 일라이트와 같은 이차광물 내에 잔류하기 때문이라고 제시하였다. 또한, Teng et al. (2020)은 신선한 휘록암(diabase)과 화학적으로 풍화된 휘록암의 K 동위원소 비교를 통하여 휘록암 풍화에 의한 K 동위원소 분별이 미비함(Δ41Kfresh rock-weathered rock = 0.068‰)을 보고하였다. 그러나, 이러한 결과는 암석의 K 함유량에 따라 K 동위원소 분별 정도의 차이가 없다는 Li et al. (2021a)의 연구결과와 상반된다.
Li et al. (2021b)는 이차광물에 의한 K 동위원소 분별 정도와 기작을 이해하기 위하여 점토광물(카올리나이트와 스멕타이트)을 KCl 용액과 15일간 반응시켰다. 반응 후 12시간 내 광물 표면과 층간으로 가벼운 동위원소인 39K의 선택적 확산에 의한 운동학적 동위원소 분별(kinetic isotopic fractionation)이 발생하며(Δ41Kadsorbed-aqueous = 0.50 ~ 0.61‰), 이후 무거운 동위원소인 41K의 흡착을 통한 평형상태 동위원소 분별(equilibrium isotopic fractionation)이 발생함(Δ41Kadsorbed-aqueous = 0.72 ~ 0.82‰)을 제시하였다. 하지만, Li et al. (2021b)의 점토 광물 흡착실험 결과는 풍화로 인한 이차광물 생성시 점토 광물이 39K을 취하며 41K은 용존상으로 용출된다고 보고된 이전 연구결과들(Li et al., 2019a; Chen et al., 2020; Santiago Ramo et al., 2020; Teng et al., 2020; Wang et al., 2021)과 상반되는데, 실험 초기에 점토 광물의 격자 안으로 가벼운 K이 농축되는 반면에, 12시간 이후에는 K과 광물의 직접적인 결합이 아닌 정전기적인 인력에 의해 점토 표면에 무거운 K이 고정되었기 때문이라고 해석하였다.
해양지각(K = ~1,600 ppm)과 해양 퇴적물(K = 18,350 ppm)은 맨틀(K = 260 ppm)보다 더 많은 K을 함유하며(Hu et al., 2020 and references therein), 섭입대를 통해 맨틀로 유입되어 맨틀의 화학 조성과 동위원소 조성에 영향을 준다(Hu et al., 2021; Wang et al., 2022). 현무암질 지각의 저온 열수 변질 또는 해양 퇴적물 내 자생광물 형성시 해수로부터 ~5,000 ppm의 K이 농축되며, 해양 지각은 신선한 중앙 해령 현무암(Mid-ocean ridge basalts; 829 ppm; White and Klein, 2014)보다 고농도의 K을 함유하게 된다(Parendo et al., 2017; Hu et al., 2020 and references therein). 또한, Seyfried and Bischoff (1979)는 현무암-해수 반응 실험 결과, 150℃ 이상의 온도에서 해수의 K 농도는 증가하는 반면, 70℃ 이하의 온도에서 해수의 K 농도가 점차 감소한다고 보고하였지만, K 동위원소의 분별 방향에 대해서는 알려지지 않았다(Parendo et al., 2017).
해수(δ41K = +0.12±0.07‰)는 BSE (δ41K = -0.48±0.03‰)와 상부 대륙 지각(upper continental crust, δ41K = -0.44±0.05‰)에 비해 무거운 K 동위원소가 풍부하다(Wang et al., 2021). 해수에 무거운 K 동위원소가 농축되는 메커니즘은 아직 잘 알려져 있지 않지만, 해양으로 유입되는 전 세계 강(δ41K = -0.59±0.04‰; Wang et al., 2021)의 영향보다는 해양 현무암 및 해저 퇴적물과 해수 사이의 상호작용 결과로 해석된다(Li et al., 2019a; Hu et al., 2020; Santiago Ramos et al., 2020; Wang et al., 2020, 2021).
Parendo et al. (2017)은 해저에서 채취한 오피올라이트(ophiolite) 코어의 변질된 현무암 및 반려암은 신선한 암석에 비해 무거운 동위원소가 부화됨(△41Krock-BSE = ~ 0.68‰)을 보고하였으며, 해저지각이 해수에 의해 저온 변질되는 동안 K 동위원소 조성이 무거워지면 지각물질 순환의 지시자로 K 동위원소가 사용될 가능성을 처음으로 언급하였다. Santiago Ramos et al. (2020)은 Troodos 오피올라이트와 ODP Hole 801c에서 채취한 현무암질 암석의 K 동위원소 조성 연구를 통해 해수에 의해 저온변질된 현무암의 K 동위원소 조성은 넓은 범위의 값(△41Krock-BSE = -0.53 ~ +0.58‰)을 갖는다고 보고하였다. 위 두 연구의 상반된 결과는 Parendo et al. (2017)가 연구한 오피올라이트 코어가 변질된 상부가 아닌 상대적으로 신선한 하부(<400 m) 화산암 시료 6개만을 대상으로 하였기 때문이며(Hu et al., 2020; Santiago Ramos et al., 2020), 해수와 유사한 오피올라이트의 δ41K (+0.19±0.029‰)는 변질환경이 저온이 아닌 고온이었음을 암시한다(Liu et al., 2021). 또한, Liu et al. (2021)의 연구에 따르면 저온 변질된 현무암은 넓은 범위의 δ41K (-0.76 ~ -0.17‰)를 갖고, 평균값(-0.40±0.33‰)은 신선한 현무암(-0.44±0.17‰)과 비슷하지만 해수(+0.12±0.07‰)보다 상당히 낮은 값을 갖는다. 따라서 해수에 의해 저온 변질된 현무암은 해수로부터의 주요한 K 저장소(sink)이며, 해수의 K 동위원소 조성을 무겁게 만드는 요인이라고 제시하였다.
Santiago Ramos et al. (2018)는 퇴적률이 상대적으로 빠른 지역(8-51.6 cm/ky)의 경우 깊이에 따른 공극수의 δ41K (-0.22‰ ~ +0.27‰) 차이가 크지 않지만, 퇴적률이 상대적으로 느린 지역(0.13-2.6 cm/ky)의 경우 퇴적물의 깊이가 깊어질수록 공극수의 δ41K가 최대 1.8‰까지 감소하는 것을 확인하였다. 또한, 1-D 확산-이류-반응 모델(diffusion-advection-reaction models)을 통해 두 지역의 δ41K차이는 확산, 자생(authigenic) Al-규산염 광물의 형성, 그리고 이온 교환 동안 K 동위원소의 분별과 퇴적률 사이의 복잡한 상호작용 결과라고 제시하였다. 해양 퇴적물의 속성 과정 중 퇴적물 내 K 농도는 주요 광물인 K 장석 함량에 큰 영향을 받지만 δ41K와 K-장석 또는 이차광물 함량과의 상관성은 크지 않다(Santiago Ramos et al., 2020). 이는 퇴적층 발달로 인해 원소 거동이 이류에서 확산으로 변경되면서 가벼운 동위원소인 39K가 더 빠르게 공극수를 통해 확산된 결과로 해석된다(Bourg et al., 2010; Santiago Ramos et al., 2018). 해양 퇴적물 속성작용 동안 이차광물 형성시 K 동위원소의 분별은 레일리 분별(Rayleigh fractionation)을 따르며 분별 상수(α)는 0.9980~1.0000 (Santiago Ramos et al., 2018)이고 이는 현무암이 저온에서 열수 변질을 받을 경우(α = 0.9995±0.0003; Liu et al., 2021)와 대륙 풍화(α = 0.99985; Teng et al., 2020) 과정에서의 K 동위원소 분별에서 측정된 것과 비슷하다.
3.3 식물 섭취(plant uptake)
식물은 용액 내 주요 영양원소(칼슘, 마그네슘 등)와 미량 영양원소(구리, 아연 등)를 섭취하는 과정에서 가벼운 동위원소를 선택적으로 흡수하며, 식물체 내에서 상대적으로 가벼운 동위원소가 줄기를 통해 잎으로 이동하고 상대적으로 무거운 동위원소는 뿌리 표면에 흡착된다(Bolou-Bi et al., 2010; Caldelas et al., 2011; Jouvin et al., 2012; Li et al., 2021c).
현재까지 보고된 육상 식물의 δ41K 값은 -1.67‰ (콩; Christensen et al., 2018) ~ +1.15‰ (마카다미아 나무; Li et al., 2021c)로 시료에 따라 큰 범위의 K 동위원소 조성 차이를 보이며, 해양 식물의 δ41K 값은 +0.57‰ (김; Li, 2017) ~ +1.11‰ (다시마; Li, 2017)로 해수보다 상대적으로 높은 값을 갖는다. 육상 식물의 K 동위원소 조성이 다양하게 나타나는 이유는 다음과 같다; (1) 식물 뿌리를 통해 토양수를 흡수하고 흡수된 K이 식물 세포를 통해 뿌리에서 잎으로 이동하는 과정에서 가벼운 동위원소의 선택적 흡수 및 무거운 동위원소의 뿌리 표면 흡착으로 인한 동위원소 분별(Christensen et al., 2018; Li et al., 2021c), (2) 해수 증발암 기원인 칼륨 비료의 사용으로 인해 식물이 무거운 K 동위원소 조성을 갖는 토양수를 흡수함(Li, 2017).
Li (2017)는 K 농도에 따라 식물 세포가 각각 다른 메커니즘을 사용해 K을 흡수(uptake)한다고 제시하였다. K 농도가 낮은(<40ppm) 환경에서는 식물세포가 K을 효율적으로 섭취하기 위해 에너지 소비 이온 펌프(energy-consuming ion pumps)를 사용한다. 에너지 비용을 줄이기 위해 식물 뿌리 세포의 멤브레인에서 가벼운 K 동위원소를 우선적으로 선택하며, Li (2017)가 분석한 6개의 육상 식물 중 5개 식물의 K 동위원소 조성이 화강암보다 낮은 δ41K 값을 갖게 되었다고 제시하였다. 반면, K 농도가 높은(>40ppm) 환경에서 해양식물은 비에너지 소비 이온 채널(non-energy-consuming ion channels)을 사용하며, 식물의 이온 채널을 통해 해수로부터 K을 흡수하는 동안 K 동위원소 분별이 거의 일어나지 않는다고 제시하였다. 하지만 Li (2017)가 연구한 조류(algae)의 K 동위원소 조성은 해수보다 높으며, 세포막을 통한 확산이나 양이온 교환 과정을 통해 가벼운 K 동위원소가 해수로 선택적으로 용출됨으로써 해양 식물에 무거운 K 동위원소가 농축된다고 제시하였다.
Christensen et al. (2018)은 수경 재배실험을 통해 콩, 쌀, 밀의 성장 기간(2주~8주) 동안 뿌리, 줄기, 잎에서의 K 동위원소 분별을 관찰하였다. 뿌리와 잎의 평균 δ41K 값은 각각 -0.55±0.24‰, -0.97±0.4‰이며 콩의 줄기는 가장 낮은 값(δ41K = -1.31±0.40‰)을 보이며 식물성장 동안 식물 내에서 K 동위원소 분별이 발생함을 확인하였다. 세 종류의 식물 모두 뿌리보다 잎의 δ41K 이 더 낮은 경향을 보이지만, 줄기의 경우 콩의 줄기만 분석하였으며 성장 기간에 따른 각 부위의 K 동위원소 조성이 일정하게 증가 또는 감소하는 경향성이 확인되지는 않았다. 반면, Li et al. (2021c)은 하와이의 토양 및 식물 조직 내 K 동위원소 분석을 통하여 식물 조직의 δ41K 값의 범위를 -1.06±0.06‰ (마카다미아 나무껍질) ~ 1.15±0.09‰ (마카다미아 나무 생엽)로 보고하였다. 또한, 습한 지역 식물인 수크령(Pennisetum setaceum)의 δ41K 값은 생엽(-0.43‰) > 새싹(-0.46‰) > 뿌리(-0.5‰) > 줄기(-0.6‰) > 꽃(-0.62‰) > 씨앗(-0.74‰) > 고엽(-1.03‰) 순으로 감소하며, 건조한 지역 식물인 버펠그라스(Cenchrus ciliaris)의 δ41K 값은 생엽(+0.41‰) > 새싹(+0.35‰) > 뿌리(+0.25‰) > 줄기(+0.13‰) > 고엽(-0.35‰) 순으로 감소함을 보고하였다. 또한 Li et al. (2021c)은 수크령과 버펠그라스 뿌리를 1M 염산을 이용해 용출(leaching) 실험하였고, 각각의 △41KRoot-Source값을 -0.40 ~ -0.36‰, -0.29 ~ -0.26‰로 보고하였다. 이는 토양으로부터 39K가 선택적으로 뿌리 세포 안으로 흡수되고 41K은 뿌리 표면에 흡착되며 이때 K 동위원소 분별이 일어남을 의미한다(Christensen et al., 2018; Li et al., 2021c). 식물 내 K 동위원소 분별이 일어나는 이유는 K-펙틴산염((C6H8O6)n)이 풍부한 뿌리와 생엽에 무거운 K 동위원소가 유도되기 때문이며, 식물 세포 내 K 동위원소 조성과 K-펙틴산염 농도의 양의 상관관계(R2=0.71)로 뒷받침된다(Li et al., 2021c). 또한, Li et al. (2021c)는 식물 내 뿌리, 잎, 줄기 간 △41K 값이 나무(+0.82 ~ +2.17‰)와 풀(+0.60 ~ +0.82‰) 사이에 크게 차이가 나는 이유는 식물 내에서 이동하는 시간 차이에 따른 이온교환반응 세기와 관련이 있을 것이라고 제시하였다.
4. 결 언
지표환경에서 K 동위원소 분별을 일으키는 주요 요인들: 1) 일차광물 용해(primary mineral dissolution), 2) 이차광물 생성(secondary mineral formation), 3) 식물 섭취(plant uptake)와 각각의 요인들에 의해 일어나는 동위원소 분별의 원리를 살펴보았다. 보고된 연구결과들에서 보듯이 K 동위원소 분별 방향은 각 요인 마다 다르고, 지표환경에서 δ41K는 BSE (-0.48‰), 상부 대륙 지각(-0.47 ~ -0.35‰), 해양지각(-0.66 ~ -0.25‰), 강(-0.59 ~ -0.08‰), 해수(+0.12‰), 육상 식물(-1.67 ~ +1.15‰), 해양 식물(+0.57 ~ +1.11‰)에 따라 상당한 K 동위원소 분별이 일어남을 확인할 수 있다. 따라서 지표환경에서 K 동위원소 거동은 규산질 암석의 화학적 풍화, 이차광물 생성 및 유기물에 의한 영향이 다양함을 시사한다.
Acknowledgments
이 논문은 정부(과학기술정보통신부)의 재원으로 한국연구재단의 지원(No. 2019R1A2C2085973)과 2021년도 교육부의 재원으로 한국기초과학지원연구원 국가연구시설장비진흥센터의 지원을 받아 수행된 연구임(2021R1A6C101A415).
References
- Barnes, I.L., Garner, E.L., Gramlich, J.W., Machlan, L.A., Moody, J.R., Moore, L.J., Murphy, T.J. and Shields, W.R., 1973, Isotopic abundance ratios and concentrations of selected elements in some Apollo 15 and Apollo 16 samples. Geochimica et Cosmochimica Acta, 4, 1197-1207.
-
Berglund, M. and Wieser, M.E., 2011, Isotopic compositions of the elements 2009 (IUPAC Technical Report). Pure and Applied Chemistry, 83, 397-410.
[https://doi.org/10.1351/PAC-REP-10-06-02]

- Berner, R.A., 1999, A new look at the long-term carbon cycle. GSA Today, 9, 1-6.
- Berner, E.K. and Berner, R.A., 2012, Global Environment: Water, Air, and Geochemical Cycles. Princeton University Press, Princeton, 464 p.
-
Blum, J.D., Gazis, C.A., Jacobson, A.D. and Chamberlain, C.P., 1998, Carbonate versus silicate weathering in the Raikhot watershed within the High Himalayan Crystalline Series. Geology, 26, 411-414.
[https://doi.org/10.1130/0091-7613(1998)026<0411:CVSWIT>2.3.CO;2]

-
Bolou-Bi, E.B., Poszwa, A., Leyval, C. and Vigier, N., 2010, Experimental determination of magnesium isotope fractionation during higher plant growth. Geochimica et Cosmochimica Acta, 74, 2523-2537.
[https://doi.org/10.1016/j.gca.2010.02.010]

-
Bourg, I.C., Richter, F.M., Christensen, J.N. and Sposito, G., 2010, Isotopic mass dependence of metal cation diffusion coefficients in liquid water. Geochimica et Cosmochimica Acta, 74, 2249-2256.
[https://doi.org/10.1016/j.gca.2010.01.024]

-
Caldelas, C., Dong, S., Araus, J.L. and Weiss, D.J., 2011, Zinc isotopic fractionation in Phragmites australis in response to toxic levels of zinc. Journal of Experimental Botany, 62, 2169-2178.
[https://doi.org/10.1093/jxb/erq414]

-
Chen, H., Liu, X.-M. and Wang, K., 2020, Potassium isotope fractionation during chemical weathering of basalts. Earth and Planetary Science Letters, 539, 116192.
[https://doi.org/10.1016/j.epsl.2020.116192]

-
Chen, H., Saunders, N.J., Jerram, M. and Halliday, A.N., 2021, High-precision potassium isotopic measurements by collision cell equipped MC-ICPMS. Chemical Geology, 578, 120281.
[https://doi.org/10.1016/j.chemgeo.2021.120281]

-
Chen, H., Tian, Z., Tuller-Ross, B., Korotev, R.L. and Wang, K., 2019, High-precision potassium isotopic analysis by MCICP-MS: an inter-laboratory comparison and refined K atomic weight. Journal of Analytical Atomic Spectrometry, 34, 160-171.
[https://doi.org/10.1039/C8JA00303C]

-
Christensen, J.N., Qin, L., Brown, S.T. and DePaolo, D,J., 2018, Potassium and Calcium Isotopic Fractionation by Plants (Soybean [Glycine max], Rice [Oryza sativa], and Wheat [Triticum aestivum]). American Chemical Society Earth Space Chemistry, 2, 745-752.
[https://doi.org/10.1021/acsearthspacechem.8b00035]

-
Culkin, F. and Cox, R.A., 1966, Sodium, potassium, magnesium, calcium and strontium in sea water. Deep Sea Research and Oceanographic Abstracts, Elsevier, 13, 789-804.
[https://doi.org/10.1016/0011-7471(76)90905-0]

- Faure, G. and Mensing, T.M., 1986, Isotopes: principles and applications. John Wiley & Sons, Inc., 897 p.
- Garner, E.L., Machlan, L.A. and Barnes, I.L., 1975, The isotopic composition of lithium, potassium, and rubidium in some Apollo 11, 12, 14, 15, and 16 samples. Lunar Science Conference Proceedings, 6, 1845-1855.
-
Glendening, E.D. and Feller, D., 1995, Cation-water interactions: The M+(H2O)n clusters for alkali metals, M = Li, Na, K, Rb, and Cs. Journal of Physical Chemistry, 99, 3060-3067.
[https://doi.org/10.1021/j100010a015]

-
Hu, Y., Chen, X.-Y., Xu, Y.-K. and Teng, F.-Z., 2018, High-precision analysis of potassium isotopes by HR-MC-ICPMS. Chemical Geology, 493, 100-108.
[https://doi.org/10.1016/j.chemgeo.2018.05.033]

-
Hu, Y., Teng, F.-Z. and Chauvel, C., 2021, Potassium isotopic evidence for sedimentary input to the mantle source of Lesser Antilles lavas. Geochemica et Cosmochimica Acta, 295, 98-111.
[https://doi.org/10.1016/j.gca.2020.12.013]

-
Hu, Y., Teng, F.-Z., Plank, T. and Chauvel, C., 2020, Potassium isotopic heterogeneity in subducting oceanic plates. Science Advances, 6.
[https://doi.org/10.1126/sciadv.abb2472]

-
Huang, T.-Y., Teng, F.-Z., Rudnick, R.L., Chen, X.-Y., Hua, Y., Liu, Y.-S. and Wu, F.-Y., 2020, Heterogeneous potassium isotopic composition of the upper continental crust. Geochimica et Cosmochimica Acta, 278, 122-136.
[https://doi.org/10.1016/j.gca.2019.05.022]

-
Humayun, M. and Clayton, R.N., 1995, Precise determination of the isotopic composition of potassium: Application to terrestrial rocks and lunar soils. Geochimica et Cosmochimica Acta, 59, 2115-2130.
[https://doi.org/10.1016/0016-7037(95)00131-X]

-
Humayun, M. and Koeberl, C., 2004, Potassium isotopic composition of Australasian tektites. Meteoritics & Planetary Science, 39, 1509-1516.
[https://doi.org/10.1111/j.1945-5100.2004.tb00125.x]

-
Jacobson, A.D. and Blum, J.D., 2000, Ca/Sr and 87Sr/86Sr geochemistry of disseminated calcite in Himalayan silicate rocks from Nanga Parbat: Influence on river-water chemistry. Geology, 28, 463-466.
[https://doi.org/10.1130/0091-7613(2000)028<0463:CSASSG>2.3.CO;2]

-
Jouvin, D., Weiss, D.J., Mason, T.F.M., Bravin, M.N., Louvat, P., Zhao, F., Ferec, F., Hinsinger, P. and Benedetti, M.F., 2012, Stable Isotopes of Cu and Zn in Higher Plants: Evidence for Cu Reduction at the Root Surface and Two Conceptual Models for Isotopic Fractionation Processes. Environmental Science and Technology, 46, 2652-2660.
[https://doi.org/10.1021/es202587m]

-
Koefoed, P., Pravdivtseva, O., Chen, H., Gerritzen, C., Thiemens, M.M. and Wang, K., 2020, Potassium isotope systematics of the LL4 chondrite Hamlet: Implications for chondrule formation and alteration. Meteoritics & Planetary Science, 55, 1-15.
[https://doi.org/10.1111/maps.13545]

-
Li, S., Li, W., Beard, B.L., Raymo, M.E., Wang, X., Chen, Y. and Chen, J., 2019a, K isotopes as a tracer for continental weathering and geological K cycling. Proceedings of the national academy of sciences, 116, 8740-8745.
[https://doi.org/10.1073/pnas.1811282116]

-
Li, W., 2017, Vital effects of K isotope fractionation in organisms: observations and a hypothesis. Acta Geochimica, 36, 374-378.
[https://doi.org/10.1007/s11631-017-0167-1]

-
Li, W., Beard, B.L. and Lie, S., 2016, Precise measurement of stable potassium isotope ratios using a single focusing collision cell multi-collector ICP-MS. Journal of Analytical Atomic Spectrometry, 31, 1023-1029.
[https://doi.org/10.1039/C5JA00487J]

-
Li, W., Kwon, K.D., Li, S. and Beard, B.L., 2017, Potassium isotope fractionation between K-salts and saturated aqueous solutions at room temperature: Laboratory experiments and theoretical calculations. Geochimica et Cosmochimica Acta, 214, 1-13.
[https://doi.org/10.1016/j.gca.2017.07.037]

-
Li, W., Li, S. and Beard, B.L., 2019b, Geological cycling of potassium and the K isotopic response: insights from loess and shales. Acta Geochimca, 38, 508-516.
[https://doi.org/10.1007/s11631-019-00345-x]

-
Li, W., Liu, X.-M., Wang, K. and Koefoed, P., 2021a, Lithium and potassium isotope fractionation during silicate rock dissolution: An experimental approach. Chemical Geology, 568, 120142.
[https://doi.org/10.1016/j.chemgeo.2021.120142]

-
Li, W., Liu, X.-M., Hu, Y., Teng, F.-Z. and Hu, Y., 2021b, Potassium isotopic fractionation during clay adsorption. Geochimica et Cosmochimica Acta, 304, 160-177.
[https://doi.org/10.1016/j.gca.2021.04.027]

-
Li, W., Liu, X.-M., Hu, Y., Teng, F.-Z., Hu, Y.-F. and Chadwick, O.A., 2021c, Potassium isotopic fractionation in a humid and an arid soil-plant system in Hawai‘i. Geoderma, 400, 115219.
[https://doi.org/10.1016/j.geoderma.2021.115219]

-
Li, X., Han, G., Zhang, Q. and Zhuang, M., 2020, An optimal separation method for high-precision K isotope analysis by using MC-ICP-MS with a dummy bucket. Journal of Analytical Atomic Spectrometry, 35, 1330.
[https://doi.org/10.1039/D0JA00127A]

-
Li, Y., Wang, W., Huang, S., Wang, K. and Wu, Z., 2019c, First-principles investigation of the concentration effect on equilibrium fractionation of K isotopes in feldspars. Geochimica et Cosmochimica Acta, 245, 374-384.
[https://doi.org/10.1016/j.gca.2018.11.006]

-
Li, Y.-H., 1982, A brief discussion on the mean oceanic residence time of elements. Geochimica et Cosmochimica Acta, 46, 2671-2675.
[https://doi.org/10.1016/0016-7037(82)90386-6]

-
Liu, H., Wang, K., Sun, W.-D., Xiao, Y., Xue, Y.-Y. and Tuller-Ross, B., 2020, Extremely light K in subducted low-T altered oceanic crust: Implications for K recycling in subduction zone. Geochimica et Cosmochimica Acta, 277, 206-223.
[https://doi.org/10.1016/j.gca.2020.03.025]

-
Liu, H., Xue, Y.-Y., Zhang, G., Sun, W.-D., Tian, Z., Tuller-Ross, B. and Wang, K., 2021, Potassium isotopic composition of low-temperature altered oceanic crust and its impact on the global K cycle. Geochimica et Cosmochimica Acta, 311, 59-73.
[https://doi.org/10.1016/j.gca.2021.08.001]

-
Lyubetskaya, T. and Korenaga, J., 2007, Chemical composition of Earth’s primitive mantle and its variance: 1. Method and results. Journal of Geophysical Research: Solid Earth, 112, B03211.
[https://doi.org/10.1029/2005JB004223]

-
Meybeck, M., 1987, Global chemical weathering of surficial rocks estimated from river dissolved loads. American Journal of Science, 287, 401-428.
[https://doi.org/10.2475/ajs.287.5.401]

-
Meybeck, M., 2003, Global Occurrence of Major Elements in Rivers. Treatise on Geochemistry, 5, 207-223.
[https://doi.org/10.1016/B0-08-043751-6/05164-1]

-
Morgan, L.E., Santiago Ramos, D.P., Davidheiser-Kroll, B., Faithfull, J., Lloyd, N.S., Ellam, R.M. and Higgins, J.A., 2018, High-precision 41K/39K measurements by MC-ICP-MS indicate terrestrial variability of δ41K. Journal of Analytical Atomic Spectrometry, 33, 175-186.
[https://doi.org/10.1039/C7JA00257B]

-
Moynier, F., Vance, D., Fujii, T. and Savage, P., 2017, The Isotope Geochemistry of Zinc and Copper. Reviews in Mineralogy and Geochemistry, 82, 543-600.
[https://doi.org/10.2138/rmg.2017.82.13]

-
Palme, H. and O'Neill, H.St.C., 2014, Cosmochemical Estimates of Mantle Composition. Treatise on Geochemistry 2nd Edition, 3, 1-39.
[https://doi.org/10.1016/B978-0-08-095975-7.00201-1]

-
Parendo, C.A., Jacobsen, S.B. and Wang, K., 2017, K isotopes as a tracer of seafloor hydrothermal alteration. Proceedings of the National Academy of Sciences, 114, 1827-1831.
[https://doi.org/10.1073/pnas.1609228114]

-
Pegram, W.J., Krishnaswami, S., Ravizza, G.E. and Turekian, K.K., 1992, The record of sea water 187Os/186Os variation through the Cenozoic. Earth Planetary Science Letters, 113, 569-576.
[https://doi.org/10.1016/0012-821X(92)90132-F]

-
Peizhen, Z., Molnar, P. and Downs, W.R., 2001, Increased sedimentation rates and grain sizes 2-4 Myr ago due to the influence of climate change on erosion rates. Nature, 410, 891-897.
[https://doi.org/10.1038/35073504]

-
Peucker‐Ehrenbrink, B. and Ravizza, G., 2000, The marine osmium isotope record. Terra Nova, 12, 205-219.
[https://doi.org/10.1046/j.1365-3121.2000.00295.x]

-
Ravizza, G. and Esser, B.K., 1993, A possible link between the seawater osmium isotope record and weathering of ancient sedimentary organic matter. Chemical Geology, 107, 255-258.
[https://doi.org/10.1016/0009-2541(93)90186-M]

-
Raymo, M.E., Ruddiman, W.F. and Froelich, P.N., 1988, Influence of late Cenozoic mountain building on ocean geochemical cycles. Geology, 16, 649-653.
[https://doi.org/10.1130/0091-7613(1988)016<0649:IOLCMB>2.3.CO;2]

-
Riley, J.P. and Tongudai, M., 1967, The major cation/chlorinity ratios in sea water. Chemical Geology, 2, 263-269.
[https://doi.org/10.1016/0009-2541(67)90026-5]

-
Rudnick, R.L. and Gao, S., 2014, Composition of the Continental Crust. Elsevier Ltd, 3, 1-64.
[https://doi.org/10.1016/B0-08-043751-6/03016-4]

-
Santiago Ramos, D.P., Coogan, L.A., Murphy, J.G. and Higgins, J.A., 2020, Low-temperature oceanic crust alteration and the isotopic budgets of potassium and magnesium in seawater. Earth and Planetary Science Letters, 541, 116290.
[https://doi.org/10.1016/j.epsl.2020.116290]

-
Santiago Ramos, D.P., Morgan, L.E., Lloyd, N.S. and Higgins, J.A., 2018, Reverse weathering in marine sediments and the geochemical cycle of potassium in seawater: Insights from the K isotopic composition (41K/39K) of deep-sea pore-fluids. Geochimica et Cosmochimica Acta, 236, 99-120.
[https://doi.org/10.1016/j.gca.2018.02.035]

-
Seyfried, W.E. and Bischoff, J.L., 1979, Low temperature basalt alteration by seawater: an experimental study at 70℃ and 150℃. Geochimica et Cosmochimica Acta, 43, 1937-1947.
[https://doi.org/10.1016/0016-7037(79)90006-1]

-
Strelow, E.W.E., Toerien, F.V.S. and Weinert, C.H.S.W., 1970, Accurate determination of traces of sodium and potassium in rocks by ion exchange followed by atomic absorption spectroscopy. Analytica Chimica Acta, 50, 399-405.
[https://doi.org/10.1016/0003-2670(70)80036-8]

-
Teng, F.-Z., Hu, Y., Ma, J.-L., Wei, G.-J. and Rudnick, R.L., 2020, Potassium isotope fractionation during continental weathering and implications for global K isotopic balance. Geochimica et Cosmochimica Acta, 278, 261-271.
[https://doi.org/10.1016/j.gca.2020.02.029]

-
Teng, F.-Z., Watkins, J. and Dauphas, N., 2017, NonTraditional Stable Isotopes. Reviews in Mineralogy & Geochemistry, Mineralogical Society of America, 82, 885 p.
[https://doi.org/10.2138/rmg.2017.82.1]

-
Tian, Z., Chen, H., Fegley Jr, B., Lodders, K., Barrat, J.-A., Day, J.M.D. and Wang, K., 2019, Potassium isotopic compositions of howardite-eucrite-diogenite meteorites. Geochimica et Cosmochimica Acta, 266, 611-632.
[https://doi.org/10.1016/j.gca.2019.08.012]

-
Tian, Z., Jolliff, B.L., Korotev, R.L., Fegley Jr, B., Lodders, K., Day, J.M.D., Chen, H. and Wang, K., 2020, Potassium isotopic composition of the Moon. Geochimica et Cosmochimica Acta, 280, 263-280.
[https://doi.org/10.1016/j.gca.2020.04.021]

-
Torres, M.A., West, A.J. and Li, G., 2014, Sulphide oxidation and carbonate dissolution as a source of CO2 over geological timescales. Nature, 507, 346-349.
[https://doi.org/10.1038/nature13030]

-
Tuller-Ross, B., Marty, B., Chen, H., Kelley, K.A., Lee, H. and Wang, K., 2019a, Potassium isotope systematics of oceanic basalts. Geochimica et Cosmochimica Acta, 259, 144-154.
[https://doi.org/10.1016/j.gca.2019.06.001]

-
Tuller-Ross, B., Savage, P.S., Chen, H. and Wang, K., 2019b, Potassium isotope fractionation during magmatic differentiation of basalt to rhyolite. Chemical Geology, 525, 37-45.
[https://doi.org/10.1016/j.chemgeo.2019.07.017]

-
Wang, K. and Jacobsen, S.B., 2016, An estimate of the Bulk Silicate Earth potassium isotopic composition based on MC-ICPMS measurements of basalts. Geochimica et Cosmochimica Acta, 178, 223-232.
[https://doi.org/10.1016/j.gca.2015.12.039]

-
Wang, K., Close, H.G., Tuller-Ross, B. and Chen, H., 2020, Global Average Potassium Isotope Composition of Modern Seawater. American Chemical Society Earth Space Chemistry, 4, 1010-1017.
[https://doi.org/10.1021/acsearthspacechem.0c00047]

-
Wang, K., Peucker-Ehrenbrink, B., Chen, H., Lee, H. and Hasenmueller, E.A., 2021, Dissolved potassium isotopic composition of major world rivers. Geochimica et Cosmochimica Acta, 294, 145-159.
[https://doi.org/10.1016/j.gca.2020.11.012]

-
Wang, Z.-Z., Teng, F.-Z., Busigny, V. and Liu, S.-A., 2022, Evidence from HP/UHP metasediments for recycling of isotopically heterogeneous potassium into the mantle. American Mineralogist: Journal of Earth and Planetary Materials, 107, 350-356.
[https://doi.org/10.2138/am-2021-7923]

-
White, W.M. and Klein, E.M., 2014, Composition of the Oceanic Crust. Treatise on Geochemistry, Elsevier, 457-496.
[https://doi.org/10.1016/B978-0-08-095975-7.00315-6]

-
Xue, X., Zhang, L., Peng, Y., Li, P. and Yu, J., 2019, Effects of Mineral Structure and Microenvironment on K Release from Potassium Aluminosilicate Minerals by Cenococcum geophilum fr. Geomicrobiology Journal, 36, 11-18.
[https://doi.org/10.1080/01490451.2018.1485064]