수막재배지역의 산소수 주입 방식에 따른 지하수내 철 지중 제거 효율 평가
초록
수막재배 시설에서 양수되는 지하수에 고농도의 용존 철이 포함된 경우에, 비닐에 수산화철의 침전, 펌프의 부식 등이 발생하여 작물 생산성을 감소시키거나 장비의 유지관리 비용을 증가시키게 된다. 이와 같이 농촌지역에서 소규모로 양수되는 충적층 지하수내의 용존 철을 제거하기 위하여 산소수의 지중 주입 방식을 적용하여 처리 효율을 평가하였다. 1개 우물에서의 연속 주입 방식보다는 2개 우물을 활용한 교대 주입 방식이 지중에 충분한 산화존을 형성하여 용존 철의 제거에 보다 효과적이었으며, 목표 농도인 1 mg/L 이하로 감소시킬 수 있었다. 용존철의 제거를 위한 지중 처리 시설의 설계를 위해서는 산소수의 주입량뿐 아니라, 주입 주기성, 주입 시간 등도 검토되어야 한다.
Abstract
Groundwater with high concentrations of Fe2+ causes the precipitation of iron hydroxides and corrosion of a pump in water-curtain greenhouse regions. This can result in decreased crop productivity and increased management cost. Injection of oxygenated water into anoxic aquifers has been used in order to remove Fe2+ from alluvial groundwater. Alternating injection method with two wells produced a sufficient oxidizing zone in underground, making Fe2+ concentration drop below the target concentration of 1 mg/L. Furthermore, this method was more effective than continuous injection method with one well. In addition to injection rate of oxygenated water, injection duration, interval, and frequency should be considered when designing an efficient in-situ iron removal system.
Keywords:
in-situ iron removal, water-curtain greenhouse, oxygenated water, iron키워드:
현장 철 지중제거, 수막재배, 산소수, 철1. 서 언
시설재배는 유리온실이나 플라스틱 하우스와 같은 인공시설 하에서 인위적으로 작물을 재배하는 방법이다. 그 중 하천변의 충적 대수층이 발달한 지역에서 온실이나 비닐하우스를 이중으로 만들고, 그 사이에 지하수를 흘려 수막(water curtain)을 만들어 지하수의 보온효과를 이용하는 재배방식을 수막재배라고 한다. 수막재배는 연중 15℃ 내외의 일정한 온도를 유지하는 지하수를 이용하기 때문에 겨울철 시설재배 시 난방비 절감 및 시설 운영 안정성 측면에서 농가의 부담을 절감해 줄 수 있는 장점이 있다. 이 기술은 1984년 국내에 보급된 이후 급속히 확산되어 1991년에 1,110 ha, 2006년에 10,746 ha로 재배 면적이 증가하고 있으며 다양한 작물에 적용되고 있다(NIHHS, 2007; Lee et al., 2015). 그러나 보편적으로 하천변 충적층 대수층 내 지하수는 높은 용존 철(Fe2+)을 함유하는데, 이 지하수를 이용한 수막재배시 용존 철이 대기 중의 산소와 만나 침전함으로써 비닐이 붉게 착색되어 광투과율이 저하되는 문제가 발생하게 된다. 지하수 내 철분 함량이 1.0 mg/L 이상인 지역에서 수막재배를 할 경우 비닐의 광투과율이 20% 내외로 낮아지는 등의 문제가 있는 것으로 연구된 바 있다(Kim et al., 2003). 광투과율이 낮아지면 하우스 내의 보온 효과는 유지되나 광합성이 감소되어 작물의 생육 불량, 수량 감소, 상품가치 하락 등의 문제가 발생된다. 이러한 이유로 수막재배에 의한 난방시스템 적용이 제약을 받으며, 최근에는 암반층 지하수를 활용하여 문제를 해결하고자 하나 양수량 부족 등이 발생하기도 한다.
철과 망간의 지중 제거 기술은 산소가 풍부한 물을 관정을 통하여 주입하여 대수층의 상태를 산화상태로 만들어 지중에서 제거하는 방법으로서, 1969년에 최초 도입 후 1988년까지 전 세계적으로 100개소 이상이 건설되어 운영되고 있다(Braester and Martinell, 1988). 1960년대 유럽에서 철과 망간의 지중 제거와 관련한 연구가 시작되었으며, 1970년대 이후 실제 현장에서 시험정을 설치한 후 산소를 반복적으로 주입하여 철과 망간을 처리하는 방식에 대한 현장 연구 및 모델링이 활발히 수행된 바 있다(Hallberg and Martinell, 1976; Van Beek, 1980, 1983; Fan, 1988; Silveria, 1988; Rott et al., 1993; Appelo and Postma, 1993; Appelo et al., 1999; Mettler et al., 2001; Houben, 2004; Karakish, 2005; Buamah, 2009; van der Laan, 2009; El-Naggar, 2010; Kazak and Pozdnyakov, 2010; Jamallio, 2012). 국내의 경우에는, 대용량의 강변여과수가 본격적으로 개발되기 시작한 2000년대 중반 이후 지하수내 철과 망간의 지중 제거 기술에 대한 현장 실증 연구가 시작되었다(Choi et al., 2007; Yi et al., 2012, 2015; Kim and Yi, 2013).
지하수에서의 용존 철의 제거는 기본적으로 산화와 침전에 의해 이루어진다. 이 제거과정은 pH, 온도, 총유기탄소(TOC; total organic carbon), 용존산소 등 지하수의 물리, 화학적 상태에 의해 영향을 받는다(Filtronics, 1993). 지상 제거 방식은 지하수를 양수하여 산화나 접촉 방식에 의하여 처리하는 방식이고, 지중 제거 방식은 지중에서 철을 침전, 제거한 후 물을 이용하는 방식이다. 전자의 경우, 우리나라에서 일반적으로 상수도 분야에서 적용하고 있는 정수처리 방식이나, 수막재배와 같은 소규모로 적용하기에는 시설 규모를 고려할 때 경제성이 떨어질 것으로 보이며, 지하수 양수 이전에 용존 철을 제거하는 지중 제거 방법이 수막재배 지역에서는 유용할 것으로 판단된다.
본 연구에서는 수막재배지역에서 용존 철의 함유량이 높은 지하수에 고농도의 소규모 산소수 주입 시스템을 적용하여 산화 침전 반응을 유도함으로써 철의 지중 처리 효과를 파악하고자 하였다.
2. 연구지역
2.1 지형 및 지질
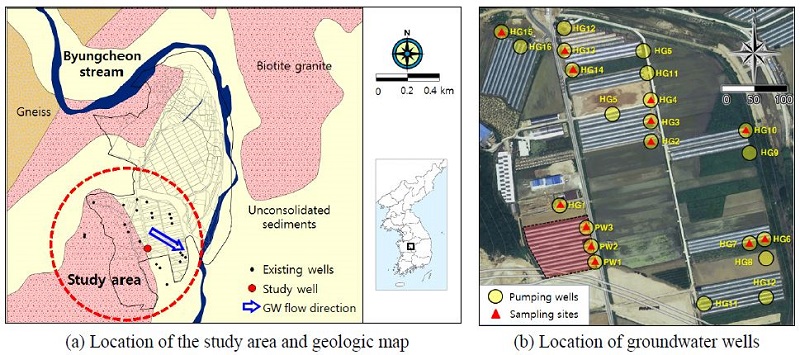
연구지역은 행정구역상으로 충청북도 청원군 오송읍 호계리 223-1번지 일대에 해당되며, 미호천을 경계로 옥산면과 강내면에 접한다. 광역적인 지형 분포를 보면, 전반적으로 평탄한 지형을 이루고 있으나 청원군의 북동 및 북서부는 주로 산악지역으로서 약 30° 이상의 급경사를 보이며, 화강암이 분포한 중앙부는 경사도가 2° 이하의 평지를 보인다. 연구지역내에는 금강 상류 미호천의 지류인 병천천이 분포하고, 연구지역 북쪽에 동림산(EL. 457 m)이 위치한다(MOCT and K-water, 2006).
청원군의 광역 지질은 경기편마암복합체, 옥천누층군, 대보화강암류, 백악기 퇴적암류 및 암맥류, 충적층 등 다섯 개의 대표적인 지질단위로 구분된다. 북서부에 위치한 경기편마암복합체는 기저를 이루고 있으며, 남동부에는 시대미상의 옥천누층군이 경기편마암복합체와 부정합관계로 접하고 있고, 중앙부에는 이들을 관입한 중생대 대보화강암이 대상으로 분포한다. 또한 백악기 퇴적암류인 초평층은 북서부에 소규모로 경기편마암 복합체 내에 협재하며, 백악기 암맥류들이 산재되어 있다. 제 4기의 충적층은 하천 부근과 넓은 평야지대에 발달되어 있다. 충적층은 주로 미호천 유역에 크게 분포하는데, 이는 백악기의 모든 암체를 부정합으로 덮고 있으며 주로 미고결의 자갈, 모래 및 점토 등으로 구성되어 있다(Kwon and Jin, 1974). 연구지역은 기반암인 흑운모 화강암을 피복하고 있는 하천 주변에 넓게 분포한 충적층에 위치하고 있다(그림 1(a)).
2.2 실험현장 구축
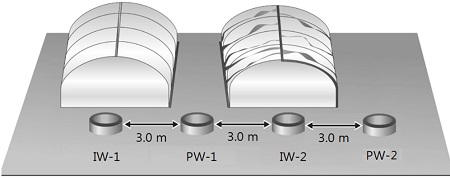
산소수의 주입을 통한 지중 철 처리 시스템 구축 및 효과를 평가하기 위하여, 연구지역 내 남서측에 위치한 수막재배용 양수정으로 활용되고 있는 PW-1 및 PW-2 주변에 주입정 2개소(IW-1, IW-2)를 설치하였다(그림 1, 2; 표 1). 주입정 일대 지질분포 특성은, 심도 0~1.5 m는 매립층으로 황갈색의 실트질 모래층, 심도 1.5~5.0 m는 암갈색 실트질 점토층의 퇴적층, 심도 5.0~6.8 m는 실트질 모래층의 퇴적층, 심도 6.8~8.3 m는 중립질~조립질의 모래 섞인 자갈층 및 심도 8.3~15.0 m는 풍화토층으로 구분된다. 산소수의 주입이 가능한 충적 대수층의 주요 구간을 모래 섞인 자갈층 및 하부로 판단하여 스크린을 6~15 m 심도에 설치하였다. 주입정 상부는 벤토나이트 차수재를 채움으로써 모래층으로의 지하수 유입을 최대한 방지하였고 지표에서 0.5 m 심도까지 그라우팅으로 밀폐하였다.
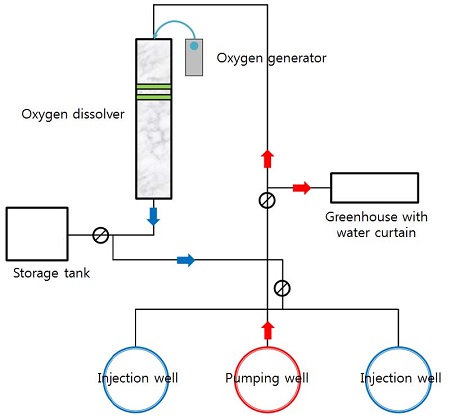
고농도의 산소를 포함한 산소수 주입시스템은 산소 발생부, 용해부, 이송 및 주입부 등으로 구성하였다. 산소 발생장치의 원리는 분자흡착제(zeolite)를 이용하여 주변 공기 중의 질소만을 선택적으로 흡착하여 산소를 분리하는 기술로 전기만을 사용하여 지속적으로 산소를 생산한다. 본 연구에 사용된 산소발생기는 순도 90% 이상의 산소를 7 L/min로 공급할 수 있으며, 산소 용해장치의 처리수량은 330 m3/day이다. 이송 및 주입배관은 직경 50 mm의 PE관를 사용하였으며, 겨울철 동결을 방지하기 위해 지하 1 m 깊이로 매설하였다. 양수된 지하수는 산소용해기와 수막 하우스로 나뉘어 들어갈 수 있도록 설계하였으며, 각 배관에 밸브를 설치하여 수막 재배와 산소수 주입시스템이 서로 영향이 없도록 하였다. 또한 이송배관에 유량계를 설치하여 정확한 유량 측정이 가능하도록 하였고, 별도의 수질시료 채취관을 설치하였다(그림 3).
2.3 지하수 수질 특성
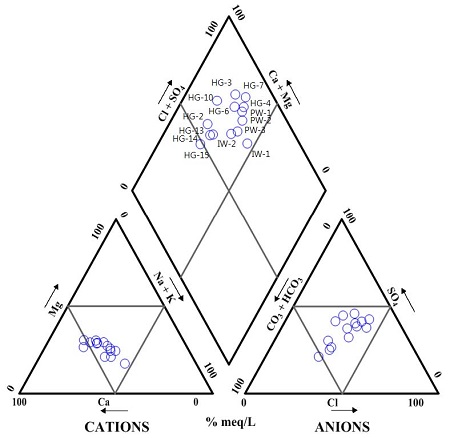
연구지역 인근의 지하수 이용관정은 양수정 PW-1, PW-2, PW-3을 포함하여 총 21개소이며, 이 중 1개 지점(HG-1)을 제외한 모든 관정이 수막재배에 이용되고 있다(그림 1). 수막재배 이용 관정 중 비닐의 착색이 심한 비닐하우스 시설을 중심으로 시료채취 지점 13개소를 선정하여 2014년 4월에 수질분석을 실시하였다(표 1). 지하수의 수소농도(pH)는 4.36~6.91의 범위로 산성에서 중성까지 나타났는데, 평균 5.32이며 PW-2에서 6.91로 가장 높고 HG-4에서 4.36로 가장 낮다. 전기전도도(EC)의 범위는 233~490 μS/cm이며 평균 318 μS/cm이다. 용존산소(DO)는 0.69~5.16 mg/L 범위이며 평균 2.38 mg/L로 대부분 낮은 값을 나타낸다. 산화환원전위(Eh)의 경우 244~540 mV으로 폭넓은 범위를 나타내지만, Fe2+ 농도가 5 mg/L 이상을 나타내는 지점의 Eh는 평균 268 mV로 환원환경을 나타낸다. 주요 이온성분 분석 결과, 양이온의 경우 Ca2+가 17.54~41.31 mg/L (평균 25.88 mg/L), Na+이 6.54~34.97 mg/L (평균 18.08 mg/L)로 우세하였고, 음이온의 경우에는 SO42-, Cl-, HCO3-가 비슷하게 나타났다. 파이퍼도를 이용하여 지하수의 수질유형을 확인한 결과, 연구지역 이용관정은 대부분 우세한 유형이 없는 것으로 나타났으며, 일부 지점에서 Ca-HCO3 유형이 나타났다(그림 4). 지하수 내 Fe2+ 농도는 평균 6.27 mg/L으로 PW-2에서 최고 21.5 mg/L, HG-6에서 최저 0.02 mg/L로 분석되었다. 지점별로 연구지역 남동쪽에 위치한 HG-6, HG-7, HG-10은 수막재배 한계농도인 1 mg/L 미만(JBARES, 1994)으로 나타났고 그 외 나머지 모든 지점에서 1 mg/L 이상으로 나타났다. 특히 PW-2, PW-3의 Fe2+ 농도는 20.9~21.5 mg/L로 매우 높았고 연구지역 북쪽에 위치한 HG-13, HG-14, HG-15에서도 6.10~8.90 mg/L 범위로 비교적 높게 나타났다.
3. 현장 실험 및 분석
3.1 산소수 연속 주입 방법
수막재배는 강변여과수와 달리 야간에 소량의 지하수를 양수하여 이용하기 때문에 산화영역이 크지 않아도 될 것으로 판단하고, 산소수 연속주입 시험과 산소수 교대주입 시험으로 구분하여 수행하였다. 산소수 연속주입 시험은 양수한 지하수의 일부를 산소수로 만들어 주입정을 통해 주입하면서 양수를 연속적으로 하는 방식으로서 2개의 주입정을 활용하였다. 산소수 교대주입 시험은 2개 이상의 관정을 활용하여 주입 및 양수를 교대로 실시하는 방식으로 수행하였다.
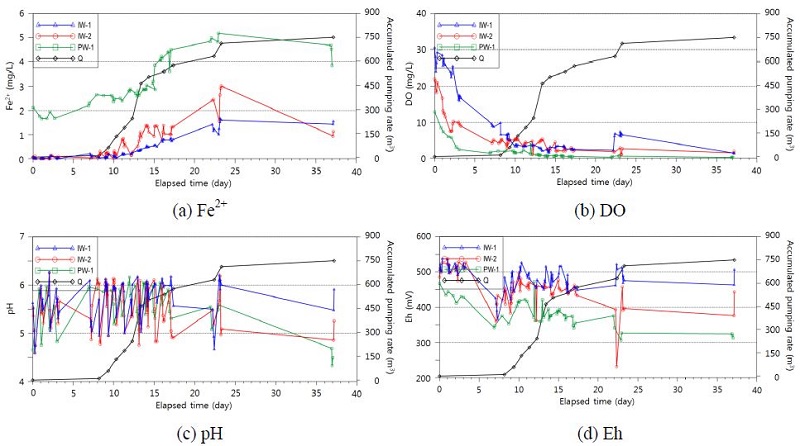
연속 주입은 표 3의 방법에 따라 주간과 야간으로 구분하여 실시되었으며, 주입되지 않고 남는 수량은 인근 하천으로 우회시켜 방류하였다. 지하수 수질 및 용존 철(Fe2+)의 변화를 파악하기 위한 수질 모니터링은 양수정(PW-1) 및 주입정 2개소(IW-1, IW-2)에서 실시되었다. 그림 5는 산소수 주입에 따른 Fe2+, DO, pH, 및 Eh의 변화를 나타낸 것인데, 앞쪽 2일은 산소수 주입전의 배경치 측정결과이다. 3단계에 걸친 연속주입 결과, 1단계(주간 140 m3/day, 야간 80 m3/day) 동안의 Fe2+의 농도는 시험 초기 약 8 mg/L에서 3 mg/L까지 저감하여 안정되었으며, 이후 2단계(주간 195 m3/day, 야간 80 m3/day) 동안에는 2.3 mg/L까지 저감하였으나 더 이상의 하강은 발생하지 않았다. 이후 추가적인 농도 저감을 위하여 3단계(주간 154 m3/day, 야간 154 m3/day) 시험을 실시하였으나 목표한 1 mg/L 농도까지의 저감은 발생되지 않았다. DO의 농도는 주입정에서 산소수 주입직후 30 mg/L까지 급격하게 상승하였으나, 양수정에서는 서서히 증가하는 형태를 보여 주입 이후 일정 시간이 경과한 후에 주입 효과가 발생하고 있음을 알 수 있다. Eh가 500 mV까지 완만한 증가를 보이는 것은 Fe2+의 산화에 유리한 환경으로 바뀌는 것으로 추정할 수 있으나, pH는 산소수 주입시작 후 약 일주일간 상승하는 추세를 나타내다가 이후 하강하는 추세를 나타내었다. pH의 감소는 Fe2+의 산화속도를 감소시키는 요인으로 작용할 수 있으며(Singer and Stumm, 1970), IW-1 주입정에서 pH가 일시적으로 약 4로 측정되었는데 pH가 4 미만으로 감소하면 Fe2+의 지중저감에 불리하게 작용할 수 있다(Stumm and Morgan, 1996).
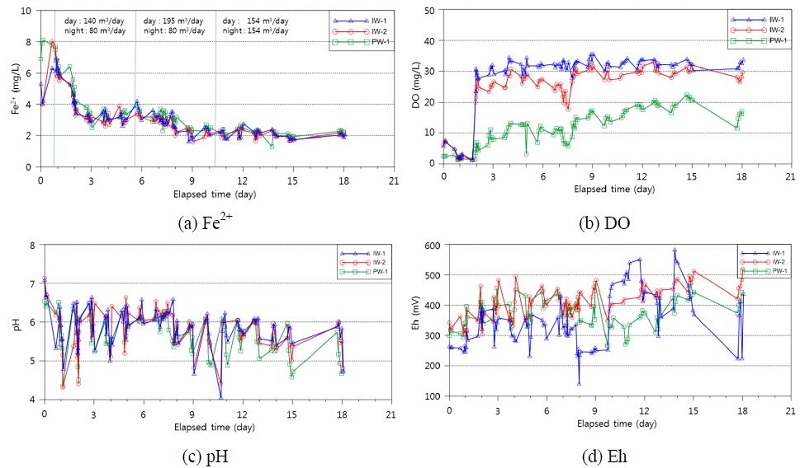
Changes in Fe2+, DO, pH, and Eh during a continuous injection of oxygenated water. (a) Fe2+, (b) DO, (c) pH, (d) Eh.
산소수 주입 종료 후 대수층 내 형성 된 산화영역과 용존 철의 제거 효과를 파악하기 위해 각 관정에서 일 4~5회 주기로 약 41일 동안 지하수 수질 변화를 관측하였다. 주입 중단 후 초기 9일간은 양수하지 않는 자연조건에서, 이후에는 산소수 주입정인 IW-1 공에서 양수를 하면서 수질변화를 관측하였다. 산소수 주입 효율은 Fe2+ 농도가 1 mg/L에 이르는 시점까지 누적양수량을 이용하여 평가하였다. 양수가 없는 조건에서 PW-1 공에서는 Fe2+의 농도가 약 2 mg/L로 비교적 일정하게 유지되고 있었으나, IW-1 공에서 양수가 시작되면서 양수정과 주입정 모두 Fe2+의 농도가 증가하는 것으로 나타났다. IW-1 공에서는 양수초기 불검출 상태의 Fe2+ 농도가 서서히 상승하여 600 m3 가량 누적양수가 이루어지면 수막재배 한계농도인 1 mg/L를 초과하는 것으로 나타났다. 연속주입 방법에 의한 산소수 주입에서는 주입 이후 양수와 같은 수리학적 변화를 야기시키지 않은 경우 약 19일 간 Fe2+ 농도를 수막재배 한계농도 이하로 유지되는 효과를 얻을 수 있었다.
그림 6은 산소수 주입 종료 이후 누적시간에 따른 Fe2+, DO, pH 및 Eh의 변화를 나타낸 것이다. DO 농도는 산소수 주입을 종료한 직후부터 양수정 및 주입정 모두에서 서서히 감소하였으며, 9일 경과시점에 IW-1에서 양수를 시작한 이후에는 배경농도 수준까지 하강하였다. pH는 측정 시기별로 변동폭은 크게 나타났으나 뚜렷한 경향을 나타나지 않았으며, Eh는 양수 종료 후부터 감소하는 경향을 나타내고 환원환경으로의 변환되는 특성을 보였다. 산소수 주입 후 일정 시간 동안에는 DO의 감소에도 Eh가 높게 유지되면서 Fe2+가 제거될 수 있었으나, 양수로 인하여 주변 대수층의 지하수가 유입되면서 Fe2+ 농도가 다시 올라가고 Eh가 감소하는 것으로 판단된다.
3.2 산소수 교대 주입 방법
수막재배 시설에서 산소수 주입을 위한 별도 주입정을 설치하는 것은 추가 비용의 부담이 있기 때문에 이를 해소하고자 기존 관정 2개소(PW-1, PW-2)를 이용하여 산소수를 교대로 주입하는 시험을 수행하였다(그림 2; 표 4). 1차 주기에는 PW-1에서 지하수를 양수하여 고농도 산소수로 처리한 후 PW-2로 주입하고 대수층 내에서 산화 영역 형성 및 Fe2+ 제거에 필요한 반응시간을 거쳤으며, 2차 주기에서는 PW-2에서 양수하여 산소수를 제조하여 PW-1로 재주입하는 방식으로 시험을 수행하였다. 각 양수-주입-반응(정지) 공정을 1회 주기로 하여 총 4회 주기의 교대주입 시험을 수행하였으며, 시험을 수행하는 동안 교대 주입-양수정 PW-1, PW-2와 인접 관정 IW-1, IW-2에서 DO, pH, Eh 및 Fe2+를 측정하였다(표 4).
그림 7은 교대주입 시험의 1차 주기 산소수 주입시작 시점부터 4차 주기 종료시까지 경과시간에 따른 Fe2+, DO, pH 및 Eh의 변화를 나타낸 것이다. PW-1에서는 Fe2+ 농도는 1차 주기에 양수가 이루어져 5.8 mg/L에서 약 16.1 mg/L까지 상승하였으나, 2차 주기의 산소수 주입 종료시 약 3.6 mg/L까지 급격히 하강하였으며, 이후 2차 주기의 반응 공정시에 수막재배 한계농도인 1 mg/L 이하로 하강하여 이후 지속적으로 낮은 수준을 유지하였다. PW-2에서 Fe2+ 농도는 1차 주기에 산소수 주입이 이루어져 초기 약 13.4 mg/L에서 약 4.4 mg/L까지 감소하였으며, 2차 주기에는 양수가 이루어졌음에도 유사한 농도를 주지하였으며, 3차 주기에 1 mg/L 이하로 하강하여 이후 낮은 수준을 유지하였다. 교대 주입-양수정 PW-1, PW-2의 DO는 산소수 주입시 약 30 mg/L까지 상승하였다가 주입이 멈춘 후 감소하는 변화를 반복하였다. 반면 pH는 PW-1과 PW-2 모두에서 잦은 상승/하강을 반복하면서 완만하게 증가하는 경향을 나타내었다. PW-1의 Eh는 시험 전 172~320 mV에서 산소수 교대주입 후 약 570~617 mV로 크게 증가하여 Fe2+ 제거에 유리한 조건이 형성되는 것으로 나타났다. Eh는 PW-2에서도 시험 전 252 mV에서 시험 후 480~540 mV로 크게 증가하였으나, PW-1 보다는 상대적으로 낮은 값을 유지하였다. 이를 반영하여 Fe2+ 농도 역시 PW-1에 비하여 상대적으로 높게 나타났다.
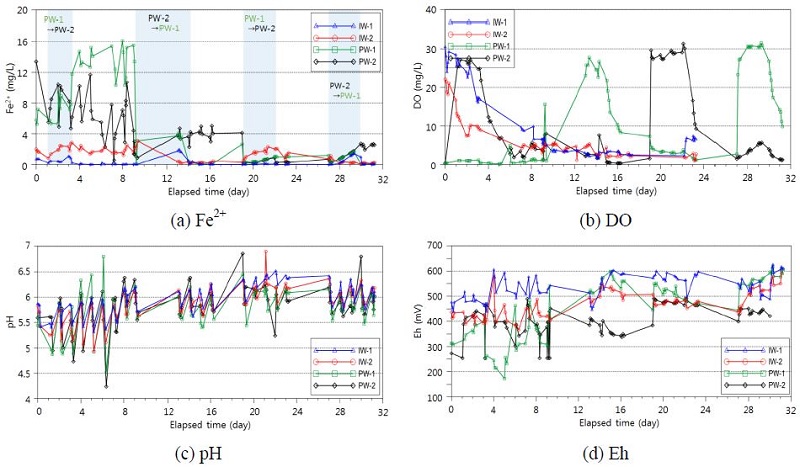
Changes in Fe2+, DO, pH, and Eh during an alternating injection of oxygenated water. (a) Fe2+, (b) DO, (c) pH, (d) Eh.
별도의 산소수 주입/양수가 이루어지지 않은 IW-1, IW-2 관정에서도 시험 전 0.71~2.04 mg/L 범위를 보이던 Fe2+ 농도가 0.04~0.29 mg/L 범위까지 하강한 것으로 나타났는데, 이는 산소수 교대 주입으로 인해 산화영역이 두 관정을 포괄하는 범위로 확장되었기 때문으로 판단된다.
4. 토 론
일반적으로 철과 망간의 제거 기작은 침전여과(floc filtration), 흡착제거(adsorptive removal) 그리고 생물학적 철 제거(biological iron removal)로 분류된다. 침전여과 기작은 지하수 속에는 Fe2+가 존재하며, 공기와 접촉한 Fe2+는 산화되어 Fe3+로 변화하게 된다. 이때 Fe3+은 물분자의 가수분해 반응에 의해 생성된 OH-와 결합하여 침전물을 형성한다(Hallberg and Martinell, 1976; Stumm and Morgan, 1996; Teutsch et al., 2005). 본 연구에서 산소수의 주입은 이와 같은 산화에 의한 침전여과 기작을 발생시키는 작용을 하게 된다.
산소수의 연속주입과 교대주입에 의한 철의 안정 광물 영역의 변화를 파악하기 위하여 pH-Eh diagram을 도시하였다(그림 8). 산소수 연속 주입시험의 경우, 철은 산소수 주입 전에 용해상인 Fe2+의 경계영역에 존재하지만 산소수 주입에 따라 Eh가 변하여 Fe2+가 Fe3+로 산화되어 수산화물로 침전하기 유리한 조건으로 바뀌는 것을 확인할 수 있다(그림 8 (a)). 산소수 교대 주입에서는 교대 주입 주기에 따른 변화를 확인할 수 있는데, 1차 주기 시험시에는 용해상의 Fe2+가 안정적인 지구화학적 조건을 나타내지만, 2차 주기 주입과 양수를 교차한 이후에는 산소수에 의해 산화조건이 형성되면서 PW-1, PW-2 모두 철수산화물의 형태로 쉽게 침전될 수 있는 영역에 도시된다(그림 8(b)). 두 방법의 주입에 따른 효과를 단순 비교하는 것은 한계가 있으나, 연속주입 방법의 경우에는 산화환원조건이 일정 주입 시간이 경과하면서 이후에 산화영역으로 이동하기는 하지만 환원영역과의 경계부에 위치하여 Fe2+ 농도의 감소에 한계적인 것으로 추정된다(그림 8(a)). 반면 교대주입 방법의 경우에 PW-1공의 변화를 보면, 1차 주입시에는 Fe2+ 감소가 나타나지 않으나 2차 및 3차를 거치면서 경계부에서 멀어진 안정된 산화영역으로 이동하여 위치하여 Fe2+ 농도의 감소 현상이 비교적 잘 나타나는 것으로 추정된다(그림 8(b)). 철의 산화는 pH의 변화에 영향을 많이 받는데, 일반적으로 pH가 1 정도 증가할 때 철의 산화 속도는 약 100배 정도 빠르게 진행이 된다고 알려져 있다(Stumm and Lee, 1961). 연속 주입의 경우에 pH는 약간 감소 또는 유지하는 경향을 보이나 교대 주입의 경우에는 증가경향을 나타내어 있어 pH 조건이 산화 작용에 보다 유리한 것으로 평가된다. 한편 Park et al. (2012)는 하천변에서 소규모 양수에 의한 지하수 내 망간저감 효과를 보고한 바 있는데, 교대주입 방식은 연속주입 방식보다 주입 위치의 변경으로 인한 수위의 급격한 변화, 유속의 변화, 물 흐름의 교란 등이 상대적으로 클 것으로 예상되어 대기와 접촉기회를 증대시켜 산화작용의 효과를 증대시킬 수 있을 것으로 추정된다.
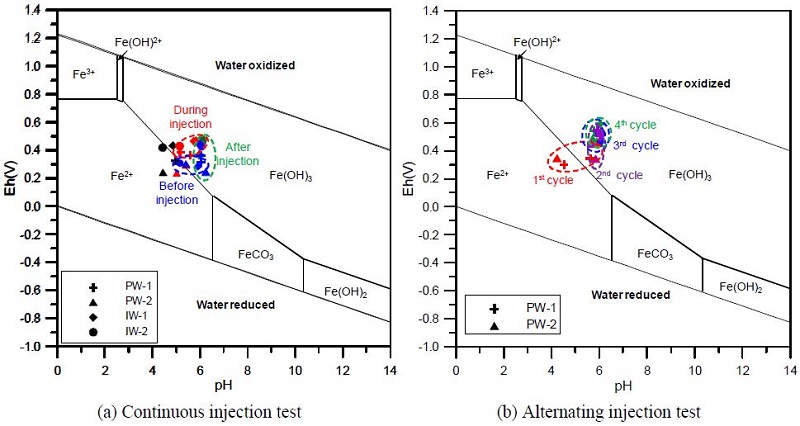
pH-Eh diagrams of the Fe-CO2-H2O system under two test conditions: FeT = 10-4 M and CT = [H2CO3] + [HCO3-] + [CO32-] = 10-2.5 M. (a) Continuous injection test, (b) Alternating injection test.
산소수를 연속적으로 주입하면서 산화영역을 만들기 위해서는 주입한 산소수가 양수정까지 안정적으로 유입되어야 하고, Fe2+가 침전 반응할 수 있는 시간이 필요하다. 또한 양수정으로 유입되는 지하수가 모두 주입정으로부터 유입되는 것은 아니기 때문에 일정 비율은 주변 대수층내의 Fe2+ 농도가 높은 지하수가 유입된다. 그림 5에서 보듯이 실제 산소수를 연속적으로 주입하는 기간에는 DO는 충분히 상승하였음에도 Fe2+는 충분히 저감되지 않으며, 주입을 멈춘 후에 농도가 더욱 낮아지는 현상이 나타났다. 연속주입 방식을 수막재배에 활용하기 위해서는 산화영역을 양수정 주변에 충분히 만들 수 있는 주입정의 배치가 필요하며, 수막에 지하수를 살포하지 않는 낮 시간대에 일정 시간 동안 주입과 양수를 멈추는 시간을 설정한다면 보다 높은 효과가 가능할 것으로 추정된다. 또한, 기존 관정을 활용한 교대 주입 방법의 경우에도, 산소수의 주입량 뿐 아니라 주입의 주기성과 주입 시간 등이 함께 고려할 필요가 있음을 보여주게 되는데, 이와 같은 최적 주입 방법의 결정은 시설의 운영관리의 효율을 위하여 필요한 사항이라 하겠다.
5. 결 언
본 연구에서는 수막재배시설 현장에서 소규모 주입정을 이용한 산소수 연속 주입 방식과 교대 주입 방식을 현장에서 적용하고 그 효과를 평가하였다. 산소수 연속주입 방식의 경우 산소수 주입시에는 일정 농도 이하로 저감이 되지 않아 수막재배 한계 농도인 1 mg/L까지 저감시키지 못하였으나, 산소수 주입을 멈춘 후에는 목적을 달성할 수 있었다. 지하수를 이용하지 않는 주간시간에 적절하게 산소수 주입과 정지 시간을 배분하면 수막재배에 이용할 수 있지만, 주입정을 충분히 만들어 산화영역을 만들기 위해서는 주입정 설치 공간과 추가 비용이 소요되므로 효율이 상대적으로 낮은 것으로 보인다. 산소수 교대주입 방식은 주입정으로 주입한 산소수가 양수정으로 유동할 때 나타나는 효율 저하를 방지하기 위하여 직접 양수정에 주입을 하는 방식으로 별도의 주입정을 만들지 않아도 된다는 경제성과 한번 산소수를 주입을 하면 장시간 이용할 수 있기 때문에 소규모 수막재배 시설에 유리한 것으로 판단된다. 본 연구에서도 교대주입 방식을 통하여 Fe2+를 수막재배 한계농도인 1 mg/L 이하로 낮출 수 있었으며, 회수를 반복하면서 효율이 증가함을 알 수 있었다.
지하수 내 고농도 철의 지중 제거는 수막재배시설의 비닐 오염 및 펌프 등의 장비 부식을 방지할 수 있으므로 난방비 및 시설관리 비용을 절감할 수 있으며, 철의 침착으로 인한 비닐의 광투과율 저하로 야기되는 작물 생산성 감소를 방지하여 수막재배의 경제성을 높일 수 있다. 아울러 대수층내로 물의 주입을 통하여 수막재배에서 문제가 되는 취수량 부족 문제 해결에도 일부 기여할 수 있어 수량과 수질 문제를 동시에 해결할 수 있을 것으로 기대된다.
Acknowledgments
본 연구는 국토교통부가 출연하고 국토교통과학기술진흥원에서 위탁시행한 물관리연구사업(11기술혁신C05)에 의한 ‘수변지하수활용고도화’연구단의 연구비 지원에 의해 수행되었습니다.
References
-
Appelo, C.A.J., Drijver, B., Hekkenberg, R., and de Jonge, M., (1999), Modeling in situ iron removal from groundwater, Ground Water, 37(6), p811-817.
[https://doi.org/10.1111/j.1745-6584.1999.tb01179.x]

- Appelo, C.A.J., and Postma, D., (1993), Geochemistry, Groundwater and Pollution, Rotterdam, Balkema, p536.
- Braester, C., and Martinell, R., (1988), The vyredox and nitredox methods of in-situ treatment of groundwater, Water Science Technology, 20(3), p149-163.
- Buamah, R., (2009), Adorptive removal of manganese, arsenic and iron from groundwater, Ph.D. Dissertation, UNESCO-IHE, Institute for Water Education, Delft, The Netherlands.
- Choi, B.Y., Yun, S.T., Kim, K.H., Koh, Y.K., and Kim, K., (2007), Removal of dissolved iron in groundwater by injection-and-pumping technique: application of reactive transport modeling, Journal of Soil and Groundwater Environment, 12(6), p29-37, (in Korean with English abstract).
- El-Naggar, H.M., (2010), Development of low-cost technology for the removal of iron and manganese from ground water in Siwa Oasis, Journal of Egypt Public Health Association, 5(3&4), p169-188.
-
Fan, M., (1988), The application of vyredox method regarding iron removal from ground water in China, Ground Water, 26(5), p647-648.
[https://doi.org/10.1111/j.1745-6584.1988.tb00799.x]

- Filtronics, (1993), Iron and manganese filtration systems: A technical discussion, Anaheim, Califonia, U.S.A, p1-13.
-
Hallberg, R.O., and Martinell, R., (1976), Vyredox - In situ purification of ground water, Ground Water, 14(2), p88-93.
[https://doi.org/10.1111/j.1745-6584.1976.tb03638.x]

-
Houben, G., (2004), Modeling the buildup of iron oxide encrustations in wells, Ground Water, 42(1), p78-82.
[https://doi.org/10.1111/j.1745-6584.2004.tb02452.x]

- Jamallio, M., (2012), Riverbank filtration: An efficient and economical drinking-water treatment technology, Dyna, 79(171), p148-157.
- JBARES (Jeollabuk-do Agricultural Research and Extension Services), (1994), Research on the Limit Concentration of Iron at the Water-curtain Greenhouse System.
- Karakish, A., (2005), Subsurface removal of iron and manganese from groundwater - case study, Ninth International Water Technology Conference, IWTC9 2005 Sharm El-Sheikh, Egypt.
-
Kazak, E.S., and Pozdnyakov, S.K., (2010), Simulation of an in situ iron removal test, Moscow University Geology Bulletin, 65(6), p399-406.
[https://doi.org/10.3103/S0145875210060074]

- Kim, G.B., and Yi, M.J., (2013), Optimum design of oxygenized water injection wells for an in-situ removal of iron and manganese in groundwater, Journal of the Geological Society of Korea, 49(5), p579-586, (in Korean with English abstract).
- Kim, K.D., Kim, . T.Y., Cho, I.H., and Nam, E.Y., (2003), Research on Water Curtain Cultivation Method in the Area of Iron-rich Groundwater, NIHHS, Wanju, (in Korean).
- Kwon, Y.I., and Jin, M.S., (1974), Geological Report of the Cheongju Sheet, Korea Research Institute of Geoscience and Mineral Resources, p8, (in Korean with English abstract).
-
Lee, B.J., Kim, Y.C., Cho, B.W., Yoon, U., Ha, K.C., Lee, B.D., Moon, S.H., Yoon, P.S., and Kim, S.Y., (2015), Estimation of groundwater usage for water curtain cultivation using a rating curve, The Journal of Engineering Geology, 25(1), p35-43, (in Korean with English abstract).
[https://doi.org/10.9720/kseg.2015.1.35]

-
Mettler, S., Abdelmoula, M., Hoehn, E., Schoenenberger, R., Weidler, P., and Gunten, U., (2001), Characterization of iron and manganese precipitates from an in situ ground water treatment plant, Ground water, 39(6), p921-930.
[https://doi.org/10.1111/j.1745-6584.2001.tb02480.x]

- MOCT (Ministry of Construction and Transportation) and K-water, (2006), Basic Groundwater Investigation of Cheongwon-Cheongju District, Seoul, (in Korean).
- NIHHS (National Institute of Horticultural and Herbal Science), (2007), Technique of Water Curtain Green House System, Wanju, (in Korean).
- Park, J.H., Son, Y.C., Cha, E.J., Shin, K.H., and Kim, G.B., (2012), Analysis of manganese reducing effect by pumping in riverside groundwater, Proceedings of KSEG 2012 Fall Conference, November 8-9, 2012.
- Rott, U., and Lamberth, B., (1993), Groundwater cleanup by in situ treatment of nitrate, iron and manganese, Water Supply, 11, p143-156.
- Silveria, L., (1988), Groundwater, Voulme III ‘In situ’ groundwater treatment, Encyclopedia of Life Support Systems (EOLSS).
-
Singer, P.C., and Stumm, W., (1970), Acid mine drainage: the rate limiting step, Science, 167, p1121-1123.
[https://doi.org/10.1126/science.167.3921.1121]

-
Stumm, W., and Lee, G.F., (1961), Oxygenation of ferrous iron, Industiral Engineering and Chemistry, 53(2), p143-146.
[https://doi.org/10.1021/ie50614a030]

- Stumm, W., and Morgan, J.J., (1996), Aquatic Chemistry, New York, John Wiley & Sons Inc, p349-515.
-
Teutsch, N., Gunten, U.V., Porcelli, D., Cirpka, O.A., and Halliday, A.N., (2005), Adsorption as a cause for iron isotope fractionation in reduced groundwater, Geochimica et Cosmochimica Acta, 69(17), p4175-4185.
[https://doi.org/10.1016/j.gca.2005.04.007]

- Van Beek, C.G.E.M., (1980), A model for the induced removal of iron and manganese from groundwater in the aquifer, In Proc. 3rd Water-Rock Interaction Symp, Edmonton, Canada, p29-31.
- Van Beek, C.G.E.M., (1983), Ondergrondse ontwijzering, een evaluatie van uitgevoerd onderzoek, mededeling nr. 78, KIWA Water Research, Nieuwegein, The Netherlands, (in Dutch).
- van der Laan, H., (2009), Investigation subsurface iron and arsenic removal: anoxic column experiments to explore efficiency parameters, Master Dissertation, UNESCO-IHE, Institute for Water Education, Delft, The Netherlands.
-
Yi, M.J., Cha, J.H., Jang, H.J., Ahn, H.S., Hahn, C., and Kim, Y.S., (2015), In situ iron-manganese removal by an oxygenated water injection-and-extraction technique in a riverbank filtration system, The Journal of Engineering Geology, 25(3), p339-347, (in Korean with English abstract).
[https://doi.org/10.9720/kseg.2015.3.339]

- Yi, M.J., Park, J.H., and Kim, G.B., (2012), In situ iron-manganese removal by the oxygenized water injection at the river bank filtration site, Journal of the Geological Society of Korea, 48(6), p503-519, (in Korean with English abstract).