확산법을 이용한 암모늄 질소 동위원소 분석법
초록
암모늄(NH4+)과 질산염(NO3-)은 수권, 토양권, 대기권 및 생물권에서 쉽게 관찰되는 질소화합물이다. 최근 한국기초과학지원연구원에서 탈질박테리아를 이용한 분석법이 개발되어 질산염에 대한 질소 및 산소 동위원소 분석이 가능해졌으나 암모늄에 대한 질소 동위원소 분석은 아직까지 이루어지지 않고 있는 실정이다. 본 연구에서는 국내 최초로 암모늄 확산법을 이용한 암모늄의 질소 동위원소 분석법을 수정보완하여 개발하였다. 암모늄 확산법은 높은 pH 환경(< 11)에서 용존된 암모늄 이온을 암모니아 가스로 기화시킨 후 이를 filter package에 ammonium sulfate 형태로 결정화시키는 일련의 과정을 포함한다. 본 연구에서 개발된 분석법의 신뢰성 검증을 위하여 2종의 국제 공인 표준물질인 IAEA-N1 (δ15N = +0.4 ± 0.2‰)과 IAEA-N2 (δ15N = +20.3 ± 0.2‰)가 사용되었다. 반응시간(1, 3, 5, 7, 10일)에 따른 암모늄의 회수율은 반응 3일 후 90% 이상을 보였으며, 반응 7일 후 시료에 대한 질소 동위원소 값(δ15N)은 IAEA-N1과 IAEA-N2에 대하여 각각 +0.4 ± 0.01‰과 +20.3 ± 0.1‰로 인증값과 오차범위 내에서 일치하였다. 이를 바탕으로 7일 반응시킨 IAEA-N1과 IAEA-N2를 10회 반복 분석한 결과 각 표준물질의 질소 동위원소 값은 각각 +0.4 ± 0.3‰과 +20.3 ± 0.2‰로 인증값과 오차범위 내에서 일치하였다. 본 연구를 통해 개발된 암모늄의 질소 안정동위원소 분석법은 향후 국내 질소순환 및 기원 추적 연구에 널리 활용될 것으로 기대된다.
Abstract
Ammonium (NH4+) and nitrate (NO3-) exist as one of the major N-bearing compounds in hydrosphere, pedosphere, atmosphere and biosphere. Although both nitrogen and oxygen isotopes of nitrate can be measured in South Korea, nitrogen isotopes of ammonium cannot be analyzed in South Korea yet. In this study, we first introduce the method of nitrogen isotope measurement of ammonium using an ammonium diffusion method. It is called as the ammonium diffusion method that dissolved ammonium ion with high pH (< 11) is converted to ammonia gas and then it is crystallized into ammonium sulfate in a filter package. During different reaction time of 1, 3, 5, 7, and 10 days, samples reacted over 3 days only showed an ammonium recovery rate of over 90%. However, measured δ15N values of samples reacted for 7 days yielded the most consistent results with certified values. To evaluate a success of the method developed in this study, two international standards, IAEA-N1 (δ15N = +0.4 ± 0.2‰) and IAEA-N2 (δ15N = +20.3 ± 0.2‰), were used. Measured their δ15N values were +0.4 ± 0.3‰ (n=10) for IAEA-N1 and +20.3 ± 0.2‰ (n=10) for IAEA-N2, respectively, in excellent agreement with recommended values within the error. The method developed in this study will help people studying nitrogen cycle and tracing sources of nitrogen in the environment.
Keywords:
Ammonium ion, nitrogen isotope, ammonium diffusion키워드:
암모늄 이온, 질소 동위원소, 암모늄 확산법1. 서 론
질소는 자연계에서 동화(assimilation), 암모니아화(ammonification), 질화(nitrification), 탈질화(denitrification) 등과 같은 과정을 거쳐 다양한 형태의 질소 화합물로 존재한다. 특히, 질소 화합물 중 암모늄 및 질산염 이온은 토양권과 수권에서 일어나는 물리, 화학, 생물학적 현상을 거쳐 생성되는 주요 질소 화합물이다(Giblin et al., 2013). 일반적으로 암모늄 이온은 수권 환경에서 암모니아 가스형태로 증발하거나 미생물에 의해 질산염 이온으로 산화되어 높은 농도로 관찰되지 않으나 인위적 오염물질에 의한 질소오염이 발생할 경우 수계의 암모늄 이온 농도가 높아질 수 있다(Camargo and Alonso, 2006). 산업화 이후 인간 활동에 의한 인위적 질소 화합물의 급격한 증가는 수권 환경에서 자연기원 질소 화합물 유입을 초과하여 나타나고 있다(Vitousek et al., 1997; Hastings et al., 2013). 예를 들어, 매립지의 침출수와 같은 농축된 폐수의 유입으로 인해 대수층에서 1~10 mmol/L의 암모늄 이온이 검출 되었으며, 농업 활동이 활발한 지역의 하천수나 정화조 배출수가 유입되는 하천수에서도 높은 농도의 암모늄 이온이 보고되었다(Christensen et al., 2001; Heaton et al., 2005). 암모늄 이온 농도의 증가는 지하수 수질에 악영향을 끼치며, 고농도의 암모늄 이온이 검출되는 지하수의 사용은 이후 지표수의 오염을 가져오기도 한다(Böhlke et al., 2006).
암모늄 이온의 질소 안정동위원소는 암모늄 이온의 거동 및 원인물질을 밝히는 지시자로 이용될 수 있으며 질소 이동에 대한 정보를 얻을 수 있는 강력한 도구로서 다양한 분야에서 활용되고 있다(Böhlke et al., 2006; Norrman et al., 2015). 이러한 이유로 다양한 암모늄의 질소 동위원소 분석법이 보고 되었다: 1) Kjeldahl 증류법을 이용한 총 질소 동위원소 분석법(Velinsky et al., 1989), 2) 수은 침전을 이용한 분석법(Fisher and Morrissey, 1985), 3) 이온 교환 수지를 이용한 암모늄 이온의 분리 분석법(Down et al., 1999), 및 4) indophenol을 이용한 추출법(Dudek et al., 1986). 그러나 이러한 분석법은 특별한 장치가 필요하거나 독성이 강한 시약을 사용할 뿐만 아니라 저농도의 암모늄 이온을 가진 지하수와 지표수의 시료에 대한 분석이 어렵다는 한계가 있다. 암모늄 확산법(ammonium diffusion)은 1939년 Conway (1939)에 의해 고안된 질소 정량분석법으로 이를 Holmes et al. (1998)과 Sebilo et al. (2004)가 질소 동위원소 분석에 적용하여 보고한 이후 현재까지 많은 연구에서 활용되고 있다(Billy et al., 2010; Zhou et al., 2012). 이에 본 연구에서는 암모늄 확산법을 이용한 암모늄 이온의 질소 동위원소 분석법을 개발하고 분석 자료의 신뢰성 확보를 위하여 2종의 국제공인표준물질인 IAEA-N1과 IAEA-N2에 대한 반복분석결과를 소개하고자 한다.
2. 시료 및 분석 방법
암모늄 이온의 질소 동위원소조성(δ15N-NH4+) 분석을 위하여 서로 다른 질소 동위원소조성을 갖는 국제공인표준물질(IAEA-N1, IAEA-N2)을 수용액으로 제조하였다. 용액 속에 녹아 있는 암모늄 이온을 회수하기 위하여 이전 연구에서 보고된 암모늄 확산법을 수정ㆍ보완하여 사용하였다(Holmes et al., 1998; Sebilo et al., 2004; Hannon and Böhlke, 2008). 본 실험에서 수정ㆍ보완된 방법은 “2.3. 암모늄 확산법을 이용한 암모늄 포집 원리”에서 설명하였다. 그림 1은 본 실험을 수행하기 위하여 사용된 암모늄 확산법을 이용한 실험 과정을 나타낸다.
2.1 표준물질제조
암모늄 이온의 질소 동위원소 분석법의 신뢰성과 재현성을 확인하기 위해 서로 다른 질소 동위원소조성을 갖는 2종의 국제공인표준물질인 IAEA-N1 ([(NH4)2SO4], δ15N = +0.4‰)과 IAEA-N2 ([(NH4)2SO4], δ15N = +20.3‰)를 사용하였다. 본 실험을 위해 분말형태의 각 표준물질 41.4 mg을 100 mL 3차 증류수에 용해시켜 NH4+ 농도가 113 mg/L가 되도록 제조하였다. 표준용액 제조시 95% 황산(TraceSELECT, Fluka) 20μL를 추가하여 표준용액의 pH를 ~2로 조정함으로써 암모늄 이온이 전처리 전까지 보존되도록 하였다.
2.2 암모늄 확산법을 이용한 전처리
실험에 사용된 시약 및 실험기구로부터 발생할 수 있는 분석오차를 최소화하기 위하여 MgO (99%, YAKURI, Japan), NaCl (99.5%, Junsei, Japan)과 일정한 크기(10 mm × 5 mm)로 자른 glass fiber (GF) filter (GF/D, Whatman, USA)를 475℃ 온도로 유지되는 연소로(FX-14, Daihan scientific)에서 4시간 동안 가열하였다. Magnetic bar와 250 mL 유리병(borosilicate)은 10% HCl 수용액을 이용하여 세척한 후 400℃ 온도로 유지되는 연소로에서 1시간 동안 가열하였다.
처리된 GF filter를 소수성의 polypropylene (PP) membrane filter (0.1 ㎛, 25 mm, Sterlitech, USA)에 올려놓고 피펫을 이용하여 20 μl의 3M NaHSO4ㆍH2O (99%, Sigma-Aldrich)를 GF filter에 첨가한 후 PP filter를 반으로 접어 밀봉하였다. Filter package 제작은 Nessler 시약(K2HgI4, Sigma-Aldrich)을 이용하여 암모늄가스가 검출되지 않는 환경을 확인한 후 수행되었다. Magnetic bar를 미리 넣어 놓은 250 mL 유리병에 1.72 mL 표준용액 IAEA-N1과 IAEA-N2를 넣고 35 g/L NaCl 수용액(pH=2)을 150 mL까지 넣어 혼합용액을 만들었다. 앞선 과정에서 제작한 filter package를 혼합용액 위에 띄운 후 약 1 g MgO를 넣고 즉시 밀봉하였다. 주입된 MgO는 pH를 높이기 때문에 혼합용액에 용존 상태로 존재하는 암모늄 이온이 암모니아 가스로 증발 손실될 수 있다. 혼합용액과 filter package를 넣은 유리병은 일정한 회전수(150 rpm)를 갖는 magnetic stirrer (color squid SA0, IKA, German)을 이용하여 천천히 교반 시켰다. 반응시간에 따른 암모늄 이온 회수율과 질소 동위원소조성 변화 여부를 확인하기 위하여 반응시간을 1, 3, 5, 7, 10일로 달리한 후 filter package를 회수하였다. 이때 각 반응시간에 대한 재현성을 확인하기 위하여 같은 시료 3개를 준비하였다. 또한, 분석 재현성 확인을 위하여 두 개의 표준용액을 각각 10개씩 만들어 반응시간 7일 후 filter package를 회수하는 실험을 추가적으로 실시하였다. 앞선 두 개의 batch 실험에서 회수한 filter package에 남아있는 MgO는 증류수를 이용하여 제거한 후 황산용액을 비치시킨 진공 데시케이터에서 48시간 동안 건조 시켰다. 안정동위원소 질량분석기를 이용한 질소 동위원소 분석시 filter package 외부의 PP filter는 제거하고 ammonium sulfate가 결정화되어 있는 GF filter만을 시료로 사용하였다.
2.3 암모늄 확산법을 이용한 암모늄 포집 원리
제조한 혼합용액에 띄워 놓은 filter package는 소수성의 PP filter가 NaHSO4ㆍH2O를 첨가한 친수성의 GF filter를 밀봉하고 있는 구조로 되어 있다. 혼합용액은 추가한 MgO에 의해 높은 pH (~11)를 나타내게 되어 혼합용액에 용존 상태로 존재하는 NH4+ 이온은 NH3 가스 형태로 확산된다; 이전 연구에서 pH를 높이기 위하여 사용된 5N NaOH 용액은(Sebilo et al., 2004) pH의 빠른 증가를 유발하여 뚜껑을 닫기 전 NH3 가스의 손실을 가져올 수 있기 때문에 MgO로 대체하였다. 반응시간 동안 용기 내 NH3 가스는 PP filter를 통과하여 filter package의 내부로 유입되고, 아래에 제시된 반응식에 따라 GF filter에 첨가된 NaHSO4ㆍH2O와 반응하여 (NH4)2SO4로 결정화 된다:
2NH3+NaHSO4+H2O→(NH4)2SO4+NaOH
이때, 혼합용액에 사용된 35 g/L NaCl 용액은 NH3의 용해도를 낮추고 용액의 삼투압을 증가시킴으로써 반응시간 동안 filter package가 온전한 상태를 유지되도록 한다(Hannon and Böhlke, 2008). Holmes et al. (1998)의 실험에서는 시료 내 암모늄 이온을 NH3 가스로 결정화시키는데 2 mol/L H2SO4 용액을 사용하였으나 분석시 사용되는 tin capsule을 산화시켜 분석데이터에 영향을 줄 수 있는 가능성이 있기 때문에 본 연구에서는 NaHSO4ㆍH2O로 대체하여 사용하였다.
2.4 암모늄 이온의 질소 동위원소 분석
전처리 과정에서 회수된 각 시료의 GF filter는 분석 전 tin capsule (9 mm × 5 mm, Thermo Scientific)를 이용하여 원소분석기(elemental analyzer)에 주입하였다. 주입된 시료는 원소분석기 내에 1050℃로 유지되는 연소 컬럼(combustion column)을 거쳐 기체화 된 후 850℃로 설정된 환원 컬럼(reduction column)을 통과하면서 질소가스로 환원된다. 환원된 질소가스는 온라인으로 연결된 안정동위원소 질량분석기(isotopic ratio mass spectrometer)로 유입되어 질소 동위원소조성이 측정된다. 본 실험에서 질소 동위원소조성은 한국기초과학지원연구원에 설치된 원소분석기(Vario PYRO cube, Elementar, German)와 온라인으로 연결된 안정동위원소 질량분석기(Isoprime 100, Isoprime, UK)를 이용하여 분석되었다. 질소 동위원소조성은 다음과 같이 Air에 상대적인 비교를 통한 델타표시법(δ)을 적용하였으며, 천분율(‰)로 나타내었다:
δ15NAir = [(15N/14N)sample/(15N/14N)reference)-1] × 1000 (‰)
분석된 시료의 질소 동위원소조성 보정을 위하여 국제공인표준물질인 IAEA-N1 (δ15N = +0.4‰)과 IAEA-N2 (δ15N = +20.3‰)를 사용하였다.
3. 결 과
국제공인표준물질 IAEA-N1과 IAEA-N2에 대한 반응시간 차이에 따른 질소 동위원소 분석결과를 그림 2에 제시하였으며 질소 동위원소 분석 결과와 함께 반응시간에 따른 용존 암모늄 이온의 회수율 변화를 그림 3에 제시하였다. 회수율은 기기 분석시 분석된 시료의 양에 비례하여 증가하는 peak height를 이용하여 계산하였다.
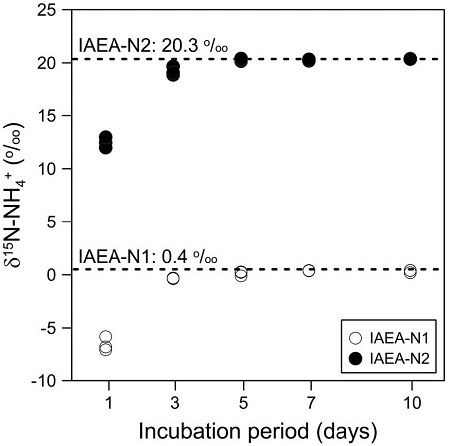
δ15N-NH4+ values of IAEA-N1 and IAEA-N2 according to incubation periods, in which the δ15N-NH4+ value is consistent after 7 days.
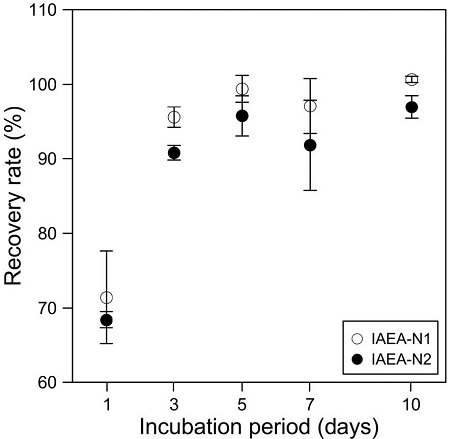
Recovery rate of dissolved ammonium ion in the IAEA-N1 and IAEA-N2 solutions during incubation periods. Over 90% of the ammonium ions were collected after 3 days.
용존 암모늄 이온의 회수율은 질소 동위원소의 분별에 가장 큰 영향을 주는 요인으로 보고되었다(Holmes et al., 1998). 본 실험에서 1, 3, 5, 7, 10일의 반응시간 동안 암모늄의 회수율은 IAEA-N1과 IAEA-N2에 대하여 각각 71.4%~100.7%와 68.4%~97.0%로 나타났다. 반응시간 및 회수율에 따른 질소 동위원소조성의 변화는 반응시간 1일(IAEA-N1 = -6.5 ± 0.6‰; IAEA-N2 = +12.5 ± 0.5‰)과 3일(IAEA-N1 = -0.3 ± 0.03‰; IAEA-N2 = +19.2 ± 0.4‰) 후 시료에서 공인값과 큰 차이를 보여주었다(그림 2). 반응 시간에 따른 회수율의 변화는 질소 동위원소조성의 변화와 비슷한 경향을 보였다(그림 2, 3). 반응시간 3일 이후의 회수율은 90% 이상으로 큰 변화가 없어 암모늄 이온의 회수는 반응 3일 이후에 대부분 완료되는 것으로 보였지만 반응시간 3일 후 시료에서의 질소 동위원소조성은 공인 값과 큰 차이를 보여 질소 동위원소 평형이 이루어지지 않았음을 확인하였다. 반응시간 5일 후부터 각 표준물질의 질소 동위원소조성이 공인값에 근접하게 나타났으며, 반응시간 7일 후부터 질소 동위원소조성이 공인 값과 오차범위 내에서 일치하고 표준편차가 상대적으로 적어 최적의 반응시간으로 판단된다.
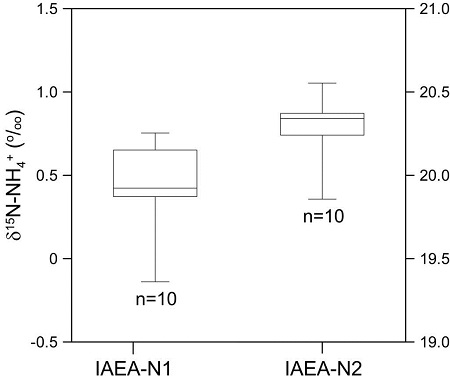
이러한 결과를 통하여 2종의 국제표준물질을 암모늄 확산법을 이용하여 7일간 반응 시킨 후 10회 반복 분석을 실시하였다. 반응시간 7일 후 IAEA-N1의 질소 동위원소조성 값은 -0.1‰ ~ +0.8‰의 범위를 보였으며(평균 +0.4 ± 0.3‰, n=10), IAEA-N2는 +19.9‰ ~ +20.6‰의 범위를 나타내었다(평균 +20.3 ± 0.2‰, n=10) (그림 4). 본 실험에서 분석된 질소 동위원소조성 값은 국제공인 값인 +0.4‰ (IAEA-N1)과 +20.3‰ (IAEA-N2)과 일치하였으며, 기존 보고 값과도 일치하였다(Sebilo et al., 2004). 따라서, 본 연구를 통하여 암모늄의 질소 동위원소 분석법이 성공적으로 개발되었음을 확인하였고 암모늄의 질소 동위원소 분석이 가능하게 됨으로써 국내 대기, 토양 및 수 환경에서 검출되는 암모늄에 대한 보다 종합적인 데이터 수집이 가능해질 뿐만 아니라 오염원 추적 연구, 질소순환 연구에 많은 도움이 될 것으로 기대된다. 또한 그 동안 전적으로 해외에 의존해서 분석하였던 암모늄의 질소 동위원소 분석이 국내에서 분석할 수 있게 됨으로써 국내 다양한 분야의 연구자들에게 보다 효과적으로 자료를 제공할 수 있을 것으로 기대된다.
Acknowledgments
본 연구는 환경부의 이산화탄소지중저장환경관리(K-COSEM) 연구단과 한국기초과학지원연구원의 주요사업(C36701)의 지원을 받았습니다. 이 논문의 개선을 위해 조언을 주신 익명의 심사자와 실험에 도움을 준 송형석 학생에게 감사드린다.
References
-
Billy, C., Billen, G., Sebilo, N., Birgand, F., and Tourenbize, J., (2010), Nitrogen isotopic composition of leached nitrate and soil organic matter as an indicator of denitrification in a sloping drained agricultural plot and adjacent uncultivated riparian buffer strips, Soil Biology & Biochemistry, 42, p108-117.
[https://doi.org/10.1016/j.soilbio.2009.09.026]

-
Böhlke, J.K., Smith, R.L., and Miller, D.N., (2006), Ammonium transport and reaction in contaminated groundwater: application of isotope tracers and isotope fractionation studies, Water Resources Research, 42, W05411.
[https://doi.org/10.1029/2005WR004349]

-
Camargo, J.A., and Alonso, Á., (2006), Ecological and toxicological effects of inorganic nitrogen pollution in aquatic ecosystem: A global assessment, Environment International, 32, p831-849.
[https://doi.org/10.1016/j.envint.2006.05.002]

-
Christensen, T.H., Kjeldsen, P., Bjerg, P.L., Jensen, D.L., Christensen, J.B., Baun, A., Albrechtsen, H.-J., and Heron, G., (2001), Biogeochemistry of landfill leachate plumes, Applied Geochemistry, 16, p659-718.
[https://doi.org/10.1016/S0883-2927(00)00082-2]

- Conway, E.J., (1939), Quantitative Analysis by the Microdiffusion Method, Crosby, Lockwood & Son, London.
-
Downs, M., Michener, R., Fry, B., and Nadelhoffer, K., (1999), Routine measurement of dissolved inorganic 15N in precipitation and stream water, Environmental Monitoring and Assessment, 55, p211-220.
[https://doi.org/10.1023/A:1006194307747]

-
Dudek, N., Brzezinski, M.A., and Wheeler, P.A., (1986), Recovery of ammonium nitrogen by solvent extraction for the determination of relative 15N abundance in regeneration experiments, Marine Chemistry, 18, p59-69.
[https://doi.org/10.1016/0304-4203(86)90076-9]

-
Fisher, T.R., and Morrissey, K.M., (1985), A new method for the recovery of ammonium from natural waters for measurement of 15N composition in isotope dilution experiments, Marine Chemistry, 16, p11-21.
[https://doi.org/10.1016/0304-4203(85)90025-8]

-
Giblin, A.E., Tobias, C.R., Song, B., Weston, N., Banta, G.T., and Rivera-Monroy, V.H., (2013), The importance of dissimilatory nitrate reduction to ammonium (DNRA) in the nitrogen cycle of coastal ecosystems, Oceanography, 26(3), p124-131.
[https://doi.org/10.5670/oceanog.2013.54]

- Hannon, J.E., and Böhlke, J.K., (2008), Determination of the δ(15N/14N) of ammonium (NH4+) in water: RSIL lab code 2898, In: Révész, K., and Coplen, T.B., (eds.) , Methods of the Reston Stable Isotope Laboratory, U.S. Geological Survey, Reston, 10-C15, p30.
-
Hastings, M.G., Cascioti, K.L., and Elliott, E.M., (2013), Stable isotopes as tracers of anthropogenic nitrogen sources, deposition, and impacts, Elements, 9, p339-344.
[https://doi.org/10.2113/gselements.9.5.339]

-
Heaton, T.H.E., Trick, J.K., and Williams, G.M., (2005), Isotope and dissolved gas evidence for nitrogen attenuation in landfill leachate dispersing into a chalk aquifer, Applied Geochemistry, 20, p933-945.
[https://doi.org/10.1016/j.apgeochem.2004.12.004]

-
Holmes, R.M., McClelland, J.W., Sigman, D.M., Fry, B., and Peterson, B.J., (1998), Measuring 15N-NH4+ in marine, estuarine and fresh waters: An adaptation of the ammonia diffusion method for samples with low ammonium concentrations, Marine Chemistry, 60, p235-243.
[https://doi.org/10.1016/S0304-4203(97)00099-6]

-
Norrman, J., Sparrenbom, C.J., Berg, M., Nhan, D.D., Jacks, G., Harms-Ringdahl, P., Nhan, P.Q., and Rosqvist, H., (2015), Tracing sources of ammonium in reducing groundwater in a well field in Hanoi (Vietnam) by means of stable nitrogen isotope (δ15N) values, Applied Geochemistry, 61, p248-258.
[https://doi.org/10.1016/j.apgeochem.2015.06.009]

-
Sebilo, M., Mayer, B., Grably, M., Billiou, D., and Mariotti, A., (2004), The use of the ‘ammonium diffusion’ method for δ15N-NH4+ and δ15N-NO3- measurements: comparison with other techniques, Environmental Chemistry, 1, p99-103.
[https://doi.org/10.1071/EN04037]

-
Velinsky, D.J., Pennock, J.R., Sharp, J.H., Cifuentes, L.A., and Fogel, M.L., (1989), Determination of the isotopic composition of ammonium-nitrogen at the natural abundance level from estuarine waters, Marine Chemistry, 26, p351-361.
[https://doi.org/10.1016/0304-4203(89)90040-6]

- Vitousek, P.M., Aber, J., Howarth, R.W., Likens, G.E., Matson, P.A., Schindler, D.W., Schlesinger, W.H., and Tilman, G.D., (1997), Human alteration of the global nitrogen cycle: Sources and consequences, Issues in Ecology, 1, p1-17.
-
Zhou, S., Sakiyama, Y., Riya, S., Song, X., Terada, A., and Hosomi, M., (2012), Assessing nitrification and denitrification in a paddy soil with different water dynamics and applied liquid cattle waste using the 15N isotopic technique, Science of the Total Environment, 430, p93-100.
[https://doi.org/10.1016/j.scitotenv.2012.04.056]