포항분지 소규모 CO2 주입 실증 부지에 대한 수치 모의 예비 결과 : 2. SO2 불순물이 지중 저장에 미치는 영향
초록
본 연구에서는 포집된 이산화탄소에 포함된 SO2 불순물이 지중 저장에 미치는 영향을 평가하고자 하였다. 연구 지역은 소규모 CO2 주입실증 부지로 포항분지 내 영일만에 위치하고 있다. 본 연구를 위해 수치 모델인 TOUGHREACT를 사용하여 다음과 같이 세 가지 경우를 모사하였다. 1) 순수 이산화탄소, 2) 99.99% 이산화탄소와 0.01% SO2, 3) 99.95% 이산화탄소와 0.05% SO2. 모델링 결과 SO2 함량이 높을수록 pH는 더 감소하였고, 그 결과 방해석의 용해량이 증가하였다. 반면 철백운석과 능철석이 생성되었으나 능철석은 주입 종료 이후 재용해되어 안정성이 매우 낮았다. 황화 광물인 황철석은 SO2 주입에 의해 생성되었으며, 황산염 광물인 경석고는 SO2 함량이 높은 경우(SO2: 0.05%)에만 주입정 인근에서 침전되었다. 주입정 인근에서 광물의 부피 변화 결과는 SO2 주입에 의해 방해석의 부피 감소가 가장 크게 나타났으며, 이로 인해 공극률과 투수율이 증가하였다. 이는 SO2 불순물이 주입 효율 향상에 일부 기여할 수 있음을 보여주었다. 하지만 탄산염 광물로 침전하는 광물 포획 능력은 순수 이산화탄소를 주입한 경우보다 감소하였다. 본 연구 결과는 이산화탄소 주입 및 저장 효율을 평가하는데 도움을 줄 것으로 보인다.
Abstract
This study is to evaluate the effect of SO2 impurity on geologic CO2 storage. Study area, a small-scale CO2 injection site, is located at Yeongil Bay within the Pohang Basin. For this study, we use TOUGHREACT geochemical code to simulate following three injection cases: 1) pure CO2, 2) 99.99% CO2 + 0.01% SO2, and 3) 99.95% CO2 + 0.05% SO2. The modeling results show that pH further decreases with higher content of SO2, which leads to the increase in calcite solubility. On the other hand, ankerite and siderite are precipitated but the stability of siderite is low because of re-dissolution after injection stop. Pyrite is formed by the injection of SO2 impurity, while anhydrite is precipitated near the injection well only in higher SO2 content (0.05%). The result of mineral volume change near the injection well shows that the largest decrease in volume occurs in calcite among minerals, which leads to the increase in porosity and permeability. This shows that SO2 impurity can enhance the injection efficiency. However, mineral trapping capacity of SO2 impurity is relatively lower than that of pure CO2. This study will be helpful to evaluate the injection and storage efficiency of CO2.
Keywords:
SO2 impurity, small scale CO2 injection, TOUGHREACT, porosity and permeability, mineral trapping키워드:
SO2 불순물, 소규모 CO2 주입실증, TOUGHREACT, 공극률과 투수율, 광물 포획1. 서 론
이산화탄소 저장 기술과 관련하여 고순도의 이산화탄소를 포집하기 위해서는 크게 1) 연소 후 포집 2) 연소 전 포집 3) 산소 연소 기술이 적용되고 있다. 하지만 이렇게 포집된 이산화탄소는 여전히 최소한 1∼2%의 불순물(N2, Ar, O2, SO2, NOx 등)을 포함하고 있으며, 고순도의 이산화탄소를 포집하기 위해서는 비용이 크게 증가하는 것으로 보고되고 있다(IEAGHG, 2011; Kummerow and Spangenberg, 2011). 포집된 이산화탄소에 포함된 불순물들은 이산화탄소의 물리적/화학적 특성에 영향을 미쳐 지중저장 효율 및 안정성에 영향을 미치는 것으로 보고되고 있다(IEAGHG, 2011). 대표적으로 N2, Ar 같은 비응축성(non-condensable) 가스류는 임계 온도를 낮추고, 밀도를 감소시키고, 점성도를 낮춤으로서 주입된 이산화탄소의 물리적 이동에 영향을 미치는 것으로 보고되고 있다(IEAGHG, 2011). 지구화학적인 관점에서는 SOX, NOX, H2S와 같은 불순물은 pH를 더 낮추어 물-암석 반응을 증가시키며, 황산염 및 황화광물을 침전시킴으로서 지중저장 용량 및 주입률에 영향을 미치는 것으로 보고되고 있다(Knauss et al., 2005; Xu et al., 2007; IEAGHG, 2011). 따라서 여러 연구자들은 SO2나 H2S 가스 함량이 물-암석 반응에 미치는 영향을 지구화학 모델링이나 실내 반응 실험을 통해 평가하고 예측하는 연구를 진행하고 있다(Knauss et al., 2005; Xu et al., 2007; Jacquemet et al., 2008; Jacquemet et al., 2009; Koenen et al., 2011; Li et al., 2011; Garcia et al., 2012). 특히 H2S와는 다르게 SO2는 소량이라 하더라도 pH를 낮추고, 이에 따라 광물의 용해/침전 반응을 증가시킴으로서 물-암석 반응에 커다란 영향을 미치는 것으로 보고되고 있다(Knauss et al., 2005; Xu et al., 2007).
본 연구에서는 수치 모델인 TOUGHREACT V.1.2 (Xu et al., 2004)를 이용하여 SO2가 지중 저장에 미치는 영향을 평가하고자 하였다. 연구 지역은 포항 영일만 해안에 위치하고 있는 “포항분지 해상 소규모 CO2 주입 실증 프로젝트” 부지로 저장층을 대상으로 이산화탄소와 SO2를 주입하는 모델링을 수행하였다. 이를 통해 본 연구에서는 주입정 인근에서 광물의 용해/침전과 투수율 및 공극률의 변화를 살펴보았다. 이러한 연구 결과는 지구화학 반응이 지중 저장에 미치는 영향을 이해하는데 기본 정보를 제공해 줄 것으로 기대된다.
2. 연구 방법
본 논문은 포항분지 소규모 CO2 주입 실증 부지에 대한 수치 모의 예비 결과를 제시하는 연속적인 결과물로서 연구지역, 모델 영역 및 CO2 유동 모델 조건은 전 논문에서 언급한 것과 동일하다. 따라서 여기서는 간략히 언급하였다.
2.1 모델 영역 및 모델 조건
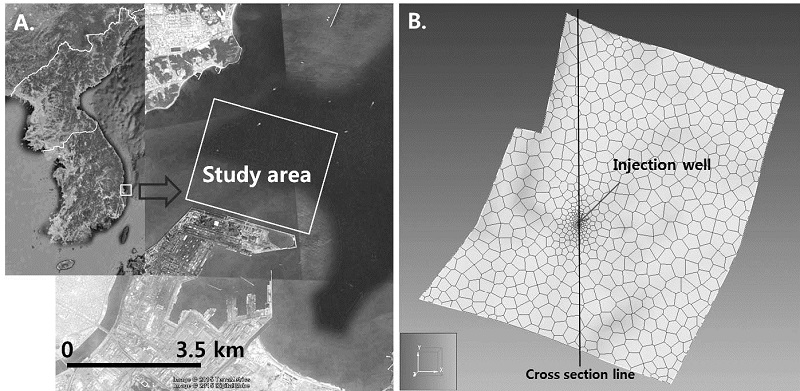
연구 지역은 경상북도 영일만 지역에 위치하고 있으며(그림 1), 이산화탄소 주입은 약 20,000 톤을 2년간 주입(약 0.3271 kg/s)하였으며, 주입 종료 후에는 100년간 물-암석 반응 변화를 모사하였다. 본 연구에서는 이산화탄소 주입에 의해 온도가 변하지 않은 등온(isothermal) 조건을 가정하였다.
2.2 수치 모델 및 수리지질학적 조건
본 연구에 사용된 수치 모델은 TOUGHREACT V.1.2 코드(Xu, 2004)에 기반 한 Petrasim (Thunderhead Engineering)을 이용하여 모델 전/후 처리를 수행하였으며, 이산화탄소 거동을 모사하기 위해 ECO2N 모듈(Pruess and Spycher, 2007)을 사용하였다. 모델에 사용된 파라미터들은 표 1에 제시하였다. 암석의 밀도는 2,600 kg/m3, 공극 압축률은 4.5×10-10로 설정하였다.
광물의 용해와 침전은 공극률과 투수율을 변화시킬 수 있다. TOUGHREACT에서 공극률 변화는 광물의 부피 변화로 계산되며, 투수율의 변화는 Verma and Pruess (1988)의 다음과 같은 함수에 의해 계산된다.
| (1) |
여기서, k0는 초기 투수율, Φ0는 초기 공극률, Φc는 투수율이 영(zero)일 때 공극률(critical porosity), n은 지수로 본 모델링에서는 Φc는 초기 공극률의 80%인 0.196, n은 2로 설정하였다(Xu et al., 2005).
2.3 지구화학 조건
저장층의 광물 조성은 탐사 시추공에서 회수된 코어에서 XRD 분석을 통해 획득하였다(표 2). 또한 표 2에 제시한 침전 가능한 2차 광물들은 포화지수가 과포화상태에 이르면 침전되도록 하였다. 침전 가능한 탄산염 광물로는 백운석(dolomite (CaMg(CO3)2)), 마그네사이트(magnesite (MgCO3)), 철백운석(ankerite (Ca(Fe, Mg)(CO3)2)), 능철석(siderite (FeCO3))로 하였다. 하지만 도오소나이트(dawsonite (NaAlCO3(OH)2))는 제외하였는데 지중 저장 조건에서 이 광물의 안정성은 아직 논쟁 중이며(Kaszuba et al., 2011), 또한 장석류가 풍부한 사암에서 주로 관찰되는 것으로 알려져 있기 때문이다(Trémosa et al., 2014). 황산염 광물인 명반석(alunite (KAl3(SO4)2(OH)))과 경석고(anhydrite (CaSO4)) 그리고 황화 광물인 황철석(pyrite( FeS2))은 SO2 주입시 침전 가능한 광물들로 고려하였다.
현재 TOUGHREACT는 다양한 열역학 자료를 활용할 수 있다. 본 연구에서는 기본적으로 제공해 주는 자료를 활용하였으며, 이것은 EQ3/6 (Wolery and Daveler, 1992)의 열역학 자료를 변환한 것이다.
저장층의 초기 물 화학 성분은 현재 측정 자료가 부재하기 때문에 표 2에 제시된 광물들을 이용하여 batch kinetic 모델링을 1000년간 수행하여 평형에 근접시킨 결과를 사용하였다. 결과는 표 3에 제시하였으며 용존 산소 농도는 음수로 제시되어 있는데 이는 TOUGHREACT에서 환원환경을 모사하기 위해 필요하다.
본 모델에서는 일부 2차 침전 광물을 제외하고는 광물의 용해/침전을 반응속도 식으로 계산하였다. 반응속도는 일반적으로 다음과 같이 표현된다(Lasaga, 1998).
| (2) |
여기서, k는 속도상수(rate constant), A는 표면적(surface area), Q는 반응지수(reaction quotient), K는 평형 상수(equilibrium constant), θ와 η는 실험에 따른 상수로 일반적으로 1로 한다. 여기서 광물의 표면적은 모델링에서 매우 중요한 파라미터로 장기간 광물 포획에 영향을 미친다(Luo et al., 2012). 광물 표면적은 자연 상태와 실험실에서 측정한 결과와 매우 차이가 큰 것으로 알려져 있다. 일반적으로 이 차이를 고려한 표면거칠기(surface roughness factor)를 적용하는데 이 값이 10에 이른다. 또한 광물 총 표면적과 반응에 참여하는 반응 표면적도 매우 큰 차이를 나타내는데 이 차이를 보정하기 위해 10-1에서 10-3의 보정 인자가 사용되고 있다(White and White, 2003; Xu et al., 2007). 이는 모델에 사용되는 광물 표면적이 매우 큰 불확실성을 지니고 있음을 나타내고 있다. 속도상수 k는 pH 범위에 따라 다양하기 때문에 규산염광물의 용해/침전은 산성 기작(acid mechanism), 중성 기작(neutral mechanism), 염기성 기작(alkaline mechanism)에 의해 조절되게 된다. 따라서 k는 다음과 같이 표현되며 이들에 대한 파라미터들은 Palandi and Kharaka (2004)의 자료를 활용하였으며, 광물의 표면적은 Xu et al. (2004)을 참고하였다(표 2).
| (3) |
여기서, N, H, OH는 산성, 중성, 염기성 기작을 나타낸다. E는 활성화 에너지(activation enegry), k25는 25℃에서 반응속도 상수(rate constant), R은 가스 상수(gas constant), T는 절대 온도(absolute temperature), a는 활동도(activity)를 나타낸다.
2.4 모델링 과정
현재 TOUGHREACT V.1.2/ECO2N은 3가지 성분(이산화탄소, 염(NaCl), 물)만을 고려하기 때문에 이산화탄소 외에 가스 상에 대해서는 운송 모델이 불가능하다. 따라서 해외 다른 연구자들이 수행한 것과 같이 SO2 가스를 염수에 용존된 상태로 주입하였다(Xu et al., 2007; Andre et al., 2012). 하지만 SO2가 용존된 상태로 주입되기 때문에 이산화탄소와 거동이 다를 수 있다. 하지만 장기간 반응을 고려한다면 대수층 내에서의 유체 혼합(mixing)에 의해 SO2 가스가 동시 주입된 경우의 지구화학 반응과 결과가 유사하다고 가정할 수 있다(Xu et al., 2007). 본 연구에서 주입된 이산화탄소와 SO2의 부피 비는 포집된 이산화탄소의 불순물 함량을 고려하여 두 가지 경우인 99.99%와 0.01%, 99.95%와 0.05%가 되도록 하였다. 불순물 SO2는 물에 완전히 용해되는 것으로 가정하였으며, 용존된 농도는 PHREEQC (Parkhurst and Appelo, 1999)를 이용하여 계산하였다. 또한 SO2 영향과 비교하기 위해 100% 이산화탄소 주입한 결과를 상호 비교하였다. 세 가지 모델링 시나리오는 다음과 같다.
- 1) 순수(100%) 이산화탄소 주입
- 2) 99.99% 이산화탄소 + 0.01% SO2
- 3) 99.95% 이산화탄소 + 0.05% SO2
3. 결과 및 토의
3.1 pH 변화
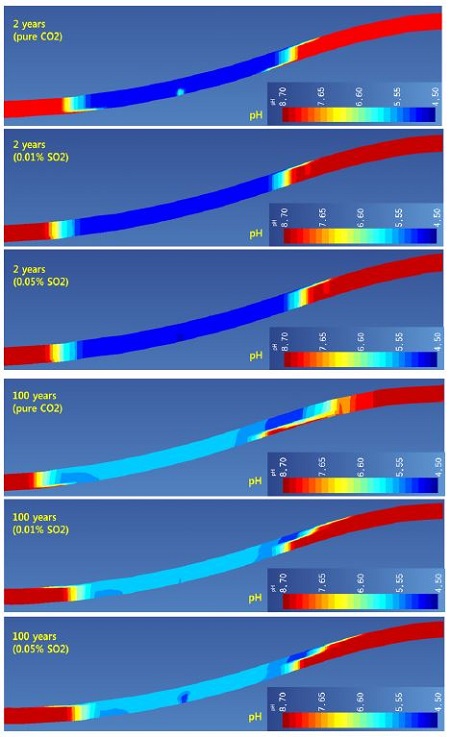
순수 이산화탄소 및 SO2를 포함하는 이산화탄소를 주입한 모델링 결과는 지구화학 반응 결과의 경향성을 파악하기 위해 그림 1에 제시한 단면을 통해 나타내었다. pH 변화는 그림 2에 제시하였다. 그림에서 보는 것과 같이 주입 2년 후 pH는 SO2 함량이 많을수록 주입정 인근에서 상대적으로 낮은 pH를 보여주고 있다. 이는 SO2가 포함된 경우 황산(H2SO4)을 형성하기 때문이다. 주입 종료 후 100년 후에도 SO2 함량이 많을수록 주입정 인근에서 pH가 상대적으로 낮음을 볼 수 있다.
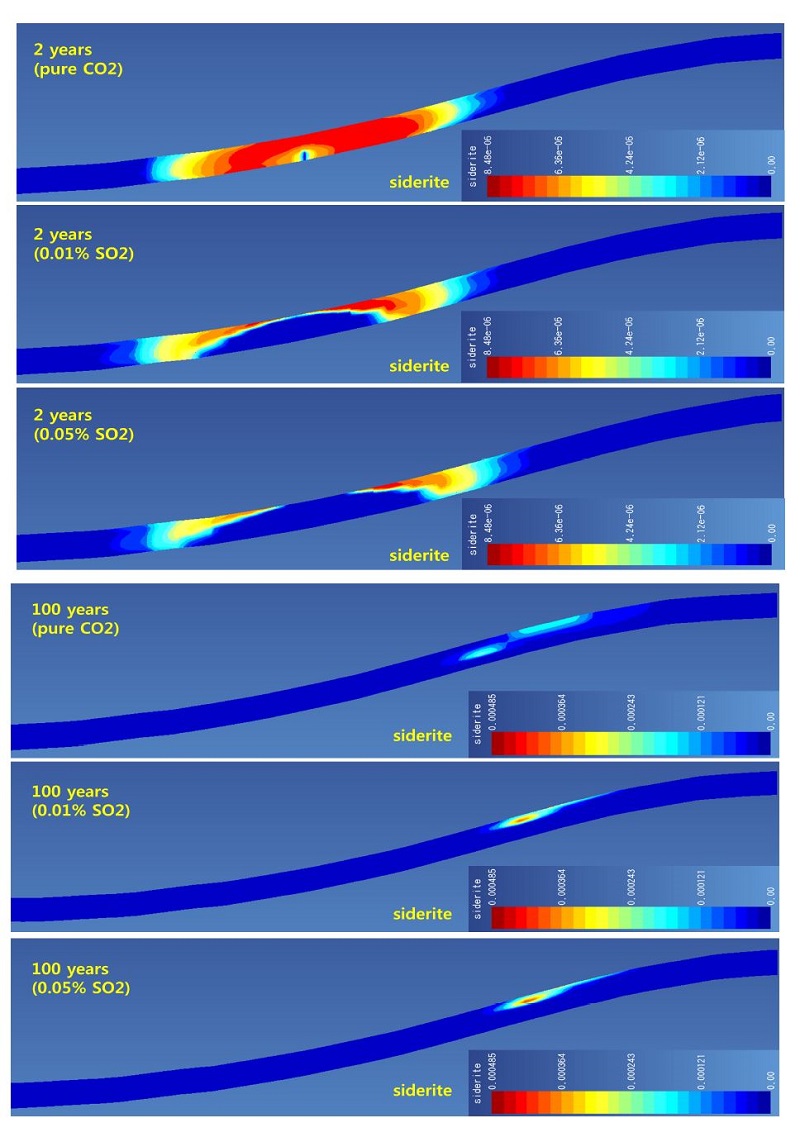
3.2 탄산염 광물 변화
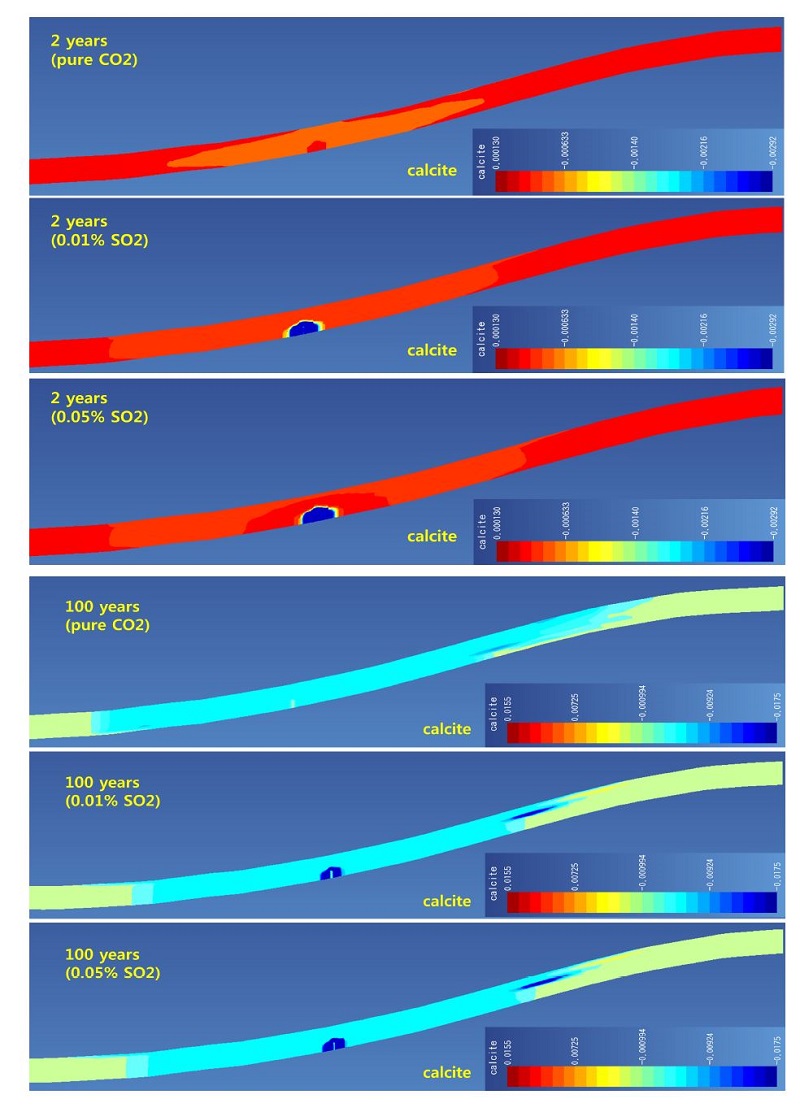
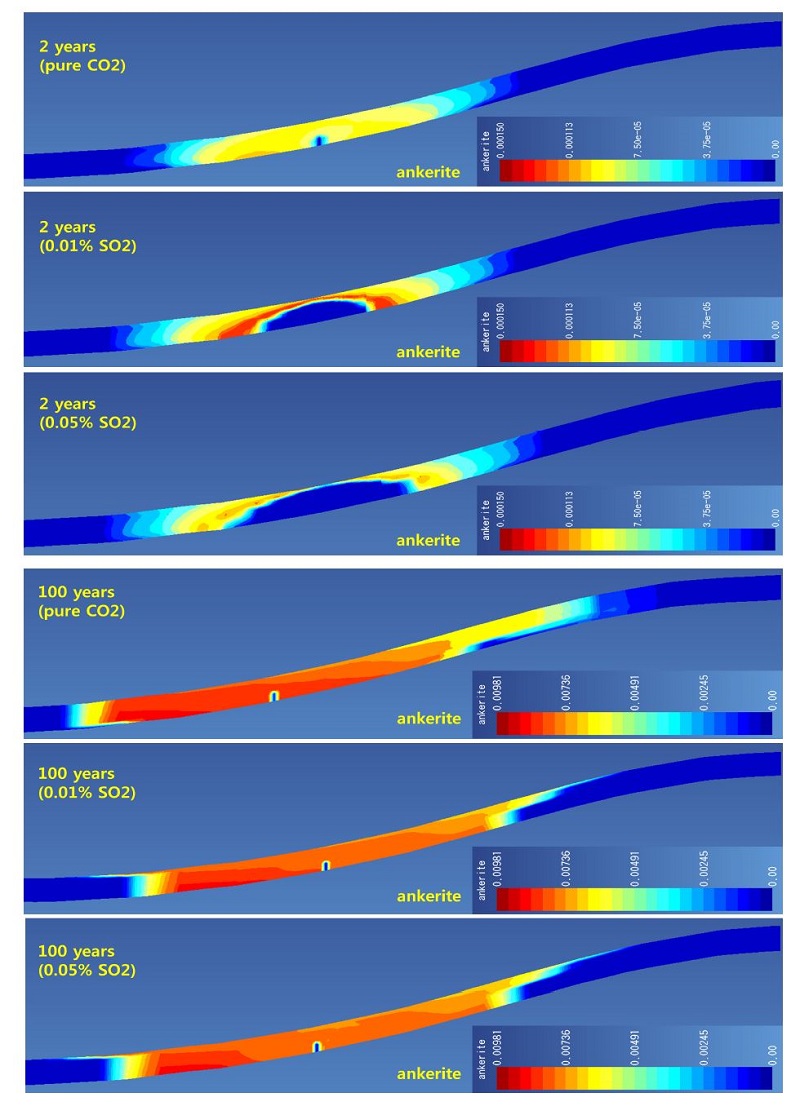
대표적인 탄산염 광물인 방해석, 철백운석, 능철석의 변화를 그림 3, 4, 5에 제시하였다. 방해석의 경우 특징적으로 모든 경우에서 용해가 주로 발생하여 부피감소가 나타나고 있다. 특히 SO2가 포함된 경우 주입정 인근에서 순수 이산화탄소인 경우보다 많은 양이 용해되었음을 볼 수 있다. 이는 주입 종료 100년 후에도 같은 경향을 보여주고 있다(그림 3). 철백운석의 경우 주입 2년 후 결과를 보면(그림 4), 순수 이산화탄소의 경우 주입정 인근에서도 침전되어 생성되고 있으나, SO2가 포함된 경우에는 주입정 인근에서 관찰되지 않는다. 특히 SO2 함량이 높을수록 주입정 인근에서 관찰되지 않는 범위가 높게 나타난다. 이러한 결과는 후술하겠지만 녹니석(chlorite)의 용해에 의해 생성된 철 이온이 황철석으로 침전되기 때문이며, SO2 함량이 높은 경우 황철석의 생성되는 범위가 더 넓기 때문이다(그림 6). 하지만 주입 종료 100년 후에는 플룸 범위의 전 영역에서 철백운석이 생성되며 이는 본 모델 조건에서 매우 안정적으로 존재하고 있음을 나타내고 있다. 능철석은 주입 2년 후에는 철백운석과 유사한 결과를 나타내고 있다(그림 5). 하지만 주입 종료 100 후에는 대부분 영역에서 용해되어 사라지고 주입된 플룸과 저장소 유체의 경계부분에서만 일부 존재하게 된다. 이는 그림 2에서 보이는 것과 같이 플룸 경계부의 pH의 분포와 관련이 있는 것으로 보이며, 능철석이 장기적인 지중 저장 관점에서 불안정하고 이산화탄소 저장에 기여하지 못하고 있음을 나타내고 있다.
3.3 황화 광물 및 황산염 광물 변화
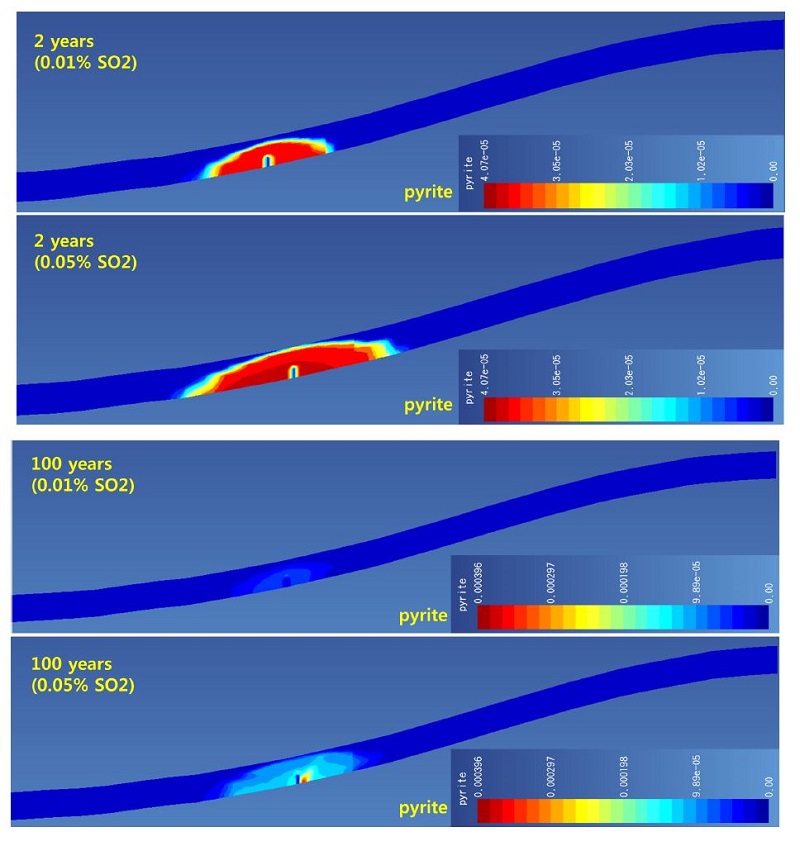
주입된 플룸의 영역에서 SO2에 의해 생성되는 황 계열 광물은 황화 광물인 황철석이다(그림 6). 그림에서와 같이 주입 2년 후 SO2 함량이 높을수록 황철석이 생성되는 영역이 더 넓음을 볼 수 있다. 또한 철백운석과 능철석 결과와 비교해보면 녹니석 용해에서 생성된 철은 SO2 주입시 우선적으로 황철석으로 형성되는 것을 알 수 있다. 주입 종료 100년 후에는 황철석 생성량이 증가하며(자료 값의 범위 참조), 특히 SO2 함량이 높은 경우 생성량이 더 많음을 볼 수 있다.
황산염 광물의 경우 추후 관측점 결과에서 보듯이 SO2 함량이 높은 경우 주입정 인근에서는 황산염 광물인 경석고가 생성되었다(그림 7).
3.4 주입정 인근에서 공극률과 투수율 변화
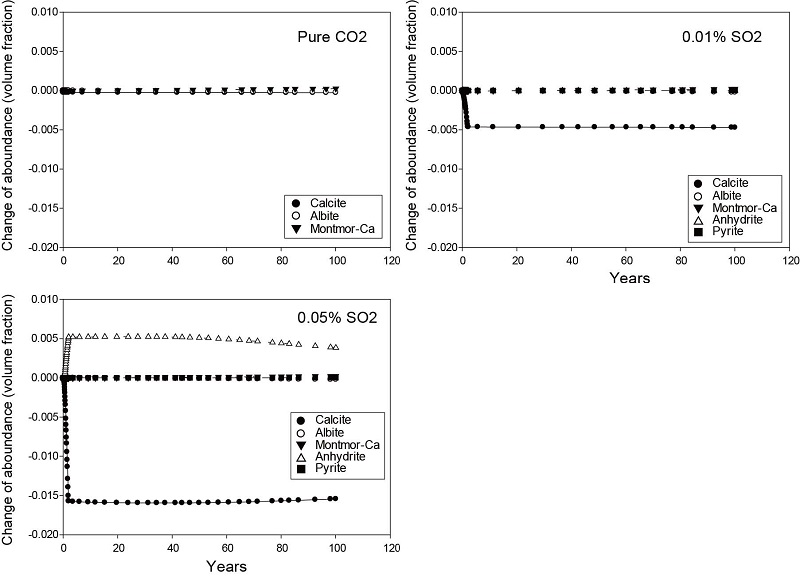
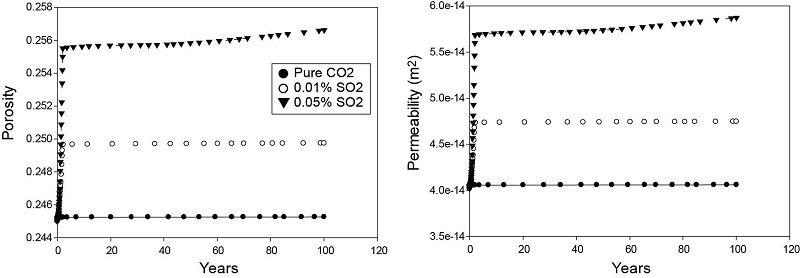
주입정 바로 옆에 위치한 관측점에서 광물의 부피 변화를 통해 공극률과 투수율 변화를 살펴보았다. 광물의 부피 변화는 초기 매질의 부피 총합에 대한 개별 광물들의 부피 변화로 나타낸다. 자료를 확인하여 부피 변화가 큰 광물들과 황 계열 광물을 제시하였다(그림 7). 순수 이산화탄소의 경우 가장 많이 용해되는 광물은 조장석(albite)과 방해석이고, 침전되는 광물은 몬모릴로나이트(montmorillonite-Ca)였다. 하지만 이들 광물의 부피 변화는 SO2가 포함된 경우에 비해 변화가 미미하게 나타난다. 하지만 SO2가 포함된 경우 뚜렷한 특징은 첫 번째로 SO2 함량이 많은 경우(SO2: 0.05%) 경석고의 생성이다. 이는 SO2 함량이 높아지면서 주입정 인근에서 황산염 농도가 상승한 것으로 보인다. 주입된 SO2에 의해 발생하는 가장 큰 특징은 방해석의 급격한 용해에 의한 부피 감소이다. 다른 광물들은 순수 이산화탄소 경우와 유사한 결과를 보여주고 있다. 이러한 방해석의 부피 변화는 공극률과 투수율 변화에 가장 큰 영향을 미치는 것으로 보인다. 이는 그림 8에서 보이는 것과 같이 SO2 함량이 높을수록 공극률과 투수율 증가가 높은 것으로 알 수 있다. SO2 함량이 0.01%인 경우 공극률은 초기 0.245에서 최대 약 0.249까지 증가하고 SO2 함량이 0.05%인 경우에는 최대 약 0.257까지 증가하였다. 투수율 또한 SO2 함량이 0.01%인 경우 초기 4.02×10-14 m2에서 최대 약 4.7×10-14 m2으로, SO2 함량이 0.05%인 경우 최대 약 5.8×10-14 m2까지 증가하였다. 반면 상대적으로 순수한 이산화탄소 주입의 경우 공극률과 투수율 증가가 매우 미미함을 볼 수 있다. 이러한 결과는 SO2가 이산화탄소와 함께 주입된 경우 주입정 인근의 공극률과 투수율을 증가시킴으로서 주입 효율을 향상 시킬 수 있음을 보여주고 있다.
3.5 저장 기작 변화
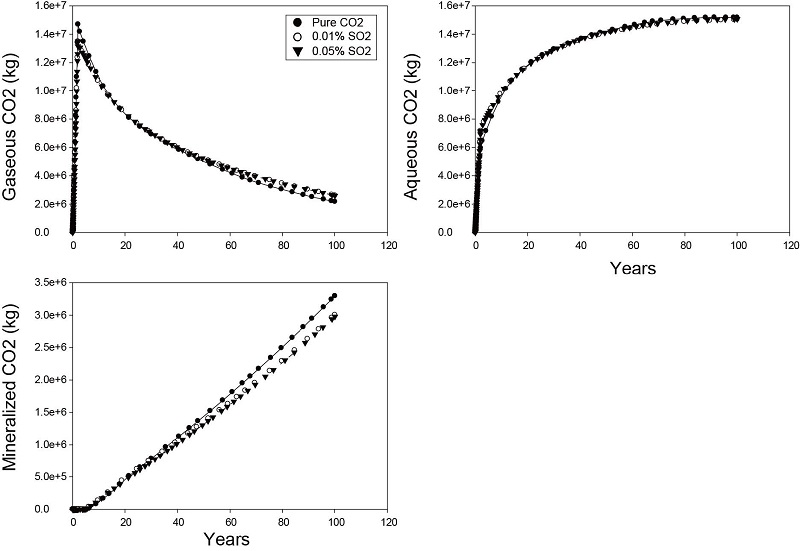
SO2 주입에 의한 저장 기작 변화를 보기위해 모델 영역 전체에서 이산화탄소의 저장 기작을 그림 9에 제시하였다. 그림에서와 같이 초임계상 이산화탄소는 주입 기간에 증가한 후 주입 종료와 함께 급격히 감소하는 반면 용해상과 광물상은 꾸준히 증가하는 것을 볼 수 있다. 순수 이산화탄소를 주입한 경우 SO2가 포함된 경우보다 시간이 지남에 따라 상대적으로 초임계상 양이 낮고 탄산염 광물로 침전된 양이 높음을 알 수 있다. 하지만 SO2가 포함된 경우에는 SO2 함량과 상관없이 두 결과가 유사함을 보여주고 있다. 즉, SO2 함량의 높고 낮음보다는 SO2 존재 유무가 저장 기작에 영향을 주는 것으로 판단된다. 이러한 결과는 SO2가 포함된 경우에는 장기적인 저장 안정성이 순수 이산화탄소가 주입된 경우보다 감소할 수 있음을 보여주고 있다.
4. 결 론
본 연구에서는 포집된 이산화탄소에 포함된 SO2 불순물이 지중 저장에 미치는 영향을 평가하기 위해 수치 모델링을 수행하였다. 모델링 결과 SO2 함량이 높을수록 pH가 낮았으며, 이로 인해 방해석의 용해가 증가하였다. 이에 따라 주입정 인근에서 공극률과 투수율이 증가하였다. 이는 SO2 함량이 주입 효율을 증가시킬 수 있음을 보여주었다. 하지만 광물 포획되는 양은 순수 이산화탄소를 주입한 경우보다 낮아 저장 안정성은 감소하는 것을 보여주었다. 따라서 모델에서 주어진 광물 조건을 고려하였을 때, 본 모델링 결과는 주입 효율이 낮은 지질 조건에서 SO2 불순물이 이산화탄소 주입에 유리함을 보여주는 반면, 주입 효율이 문제되지 않는 지질 조건에서는 SO2 불순물이 저장 안정성을 감소시키는 것을 나타내고 있다. 본 연구 결과는 이산화탄소 주입 전 예비 결과이지만 이산화탄소 주입 및 저장 효율 평가에 기본적인 정보를 제공해줄 것으로 판단된다.
Acknowledgments
본 연구는 산업통상자원부 주관 하에 한국에너지기술평가원의 지원에 의한 “포항분지 해상 소규모 CO2 주입실증 프로젝트(과제번호: 20132010201760)”과제의 연구 결과 중 일부임을 밝힙니다. 또한 한국지질자원연구원에서 수행중인 주요사업 “지중주입 이산화탄소 거동 및 누출 모니터링 현장 적용 기술개발”의 일부 지원으로 수행되었습니다. 탐사 시추공 지질 자료를 제공해 주신 공주대학교 권이균 교수님, 동아대 이대성 교수님께 감사드립니다.
References
- Andre, L., Azaroual, M., Bernstone, C., and Wittek, A., (2012), Modeling the geochemical impact of an injection of CO2 and associated reactive impurities into a saline reservoir, PROCEEDINGS, TOUGH Symposium 2012, Lawrence Berkely National Laboratory, Berkeley, California, September, p17-19.
-
Garcia, S., Rosenbauer, R.J., Palandri, J., and Maroto-Valer, M.M., (2012), Sequestration of non-pure carbon dioxide streams in iron oxyhydroxide-containing saline repositories, International Journal of Greenhouse Gas Control, 7, p89-97.
[https://doi.org/10.1016/j.ijggc.2011.12.004]

- IEAGHG, (2011), Effects of impurities on geological storage of CO2, 2011/04, June, 2011.
-
Jacquemet, N., Le Gallo, Y., Estublier, A., Lachet, V., von Dalwigk, I., Yan, J., Azaroual, M., and Audigane, P., (2009), CO2 streams containing associated components- a review of the thermodynamic and geochemical properties and assessment of some reactive transport codes, Energy Procedia, 1, p3739-3746.
[https://doi.org/10.1016/j.egypro.2009.02.173]

-
Jacquemet, N., Pironon, J., and Saint-Marc, J., (2008), Mineralogical changes of a well cement in various H2S-CO2 (-Brine) fluids at high pressure and temperature, Environmental Science and Technology, 42, p282-288.
[https://doi.org/10.1021/es070853s]

-
Kaszuba, J.P., Viswanathan, H.S., and Carey, J.W., (2011), Relative stability and significance of dawsonite and aluminum minerals in geologic carbon sequestration, Geophysical Research Letters, 38, pL08404.
[https://doi.org/10.1029/2011GL046845]

-
Kummerow, J., and Spangenberg, E., (2011), Experimental evaluation of the impact of the interactions of CO2-SO2, brine, and reservoir rock on petrophysical properties: A case study from the Ketzin test site, Germany, Geochemistry Geophysics Geosystems, 12, pQ05010.
[https://doi.org/10.1029/2010GC003469]

-
Knauss, K.G., Johnson, J.W., and Steefel, C.I., (2005), Evaluation of the impact of CO2, co-contaminant gas, aqueous fluid and reservoir rock interactions on the geologic sequestration of CO2, Chemical Geology, 217, p339-350.
[https://doi.org/10.1016/j.chemgeo.2004.12.017]

-
Koenen, M., Tambach, T.J., and Neele, F.P., (2011), Geochemical effects of impurities in CO2 on a sandstone reservoir, Energy Procedia, 4, p5343-5349.
[https://doi.org/10.1016/j.egypro.2011.02.516]

-
Lasaga, A.C., (1998), Kinetic theory in the earth science, Princeton University Press, Princeton, New Jersey, p811.
[https://doi.org/10.1515/9781400864874]

-
Li, Q., Li, X., Wei, N., and Fang, Z., (2011), Possibilities and potentials of geological co-storage CO2 and SO2 in China, Energy Procedia, 4, p6015-6020.
[https://doi.org/10.1016/j.egypro.2011.02.605]

-
Luo, S., Xu, R., and Jiang, P., (2012), Effect of reactive surface area of minerals on mineralization trapping of CO2 in saline aquifers, Petroleum Science, 9, p400-407.
[https://doi.org/10.1007/s12182-012-0224-7]

- Palandi, J.L., and Kharaka, Y.K., (2004), A compilation of rate parameters of water-mineral interaction kinetics for application to geochemical modeling, U.S. Geological Survey, Open File Report 2004-1068.
- Parkhurst, D.L., and Appelo, C.A.J., (1999), User’s guide to PHREEQC (Version 2) - A computer program for speciation, batch-reaction, one-dimensional transport, and inverse geochemical calculations, U.S. Geological Survey, Water-Resources Investigation Report 99-4259.
-
Pruess, K., and Spycher, N., (2007), ECO2N-a fluid property module for the TOUGH2 code for studies of CO2 storage in saline aquifers, Energy Conversion and Management, 48, p1761-1770.
[https://doi.org/10.1016/j.enconman.2007.01.016]

-
Trémosa, J., Castillo, C., Vong, C.Q., and Kervévan, C., (2014), Long-term assessment of geochemical reactivity of CO2 storage in highly saline aquifers: Application to Ketzin, In Salah and Snøhvit storage sites, International Journal of Greenhouse Gas Control, 20, p2-26.
[https://doi.org/10.1016/j.ijggc.2013.10.022]

-
Verma, A., and Pruess, K., (1988), Thermohydrological conditions and silica redistribution near high-level nuclear wastes emplaced in saturated geological formations, Journal of Geophysical Research, 93, p1159-1173.
[https://doi.org/10.1029/JB093iB02p01159]

- Wolery, T.J., and Daveler, S.A., (1992), EQ6, A computer program fro reaction path modeling of aqueous geochemical system: theoretical manual, user’s guide, and related documentation (version 7.0), Lawrence Livemore National Laboratory, UCRL-MA-110662 PT IV.
- Xu, T., Sonnenthal, E., Spycher, N., and Pruess, K., (2004), TOUGHREACT User’s Guide: A simulation Program for Non-isothermal Multiphase Reactive Geochemical Transport in Variably Saturated Geologic Media, Earth Science Division, Lawrence Berkeley National Laboratory, University of California, Berkeley, CA 94720.
- Xu, T., Zhang, G., and Pruess, K., (2005), Use of TOUGHREACT to simulate effects of fluid chemistry on injectivity in fractured geothermal reservoirs with high ionic strength fluids, PROCEEDINGS, Thirtieth Workshop on Geothermal Reservoir Engineering, Stanford University, Stanford, California, January 31-February 2, SGP-TR-176.
-
Xu, T., Apps, J.A., Pruess, K., and Yamamoto, H., (2007), Numerical modeling of injection and mineral trapping of CO2 with H2S and SO2 in a sandstone formation, Chemical Geology, 242, p319-346.
[https://doi.org/10.1016/j.chemgeo.2007.03.022]