현무암의 덮개암 역할 가능성에 대한 지구화학 모델링 연구
초록
CO2 지중 저장소에서 현무암의 덮개암 역할 가능성을 평가하기 위해 지구화학 모델링을 수행하였다. 이를 위해 다양한 CO2 분압(10, 50, 100 bar) 조건에서 CO2-현무암-물 상호반응을 모사하였다. 그 결과 pH는 반응시간에 따라 4단계로 변화하였으며, 이러한 변화는 새로운 2차 광물의 생성에 의해 조절되는 것으로 나타났다. 첫 번째 단계(pH < 8.8)에서는 Ca-Mg-Fe 탄산염 광물들(돌로마이트(dolomite), 능철석(siderite), 철백운석(ankerite))과 점토 광물들(바이델라이트(beidellite)-Mg, 사포나이트(saponite)-Mg-Mg, 사포나이트-Mg-Na, 바이델라이트-Na)이 새로 생성되었다. 2단계(pH = 8.8)에서는 방해석(calcite)와 점토광물들(녹니석(chlorite)-Mg, 녹니석-Fe)이 생성되어 함량이 꾸준히 증가하였고, 제올라이트(zeolite)가 침전되기 시작하였다. 3단계(8.8 < pH < 9.7)에서는 제올라이트가 급격히 증가한 반면 방해석와 점토광물들은 함량이 거의 일정하였다. 마지막 단계(pH = 9.7)에서 제올라이트와 점토 광물들은 함량이 지속적으로 증가하였으나 방해석은 일정하였다. 2차 광물들의 생성에 따라 현무암의 공극률은 10 bar CO2에서는 약 5.4%, 50 bar CO2에서는 약 7.9%, 100 bar CO2에서는 약 10.1%가 감소하였다. 점토 광물의 생성이 모든 pH 범위에서 공극률 감소에 중요한 역할을 하는 것으로 나타났다. 이 결과는 현무암의 공극률이 CO2-현무암-물 상호작용에 의해 감소함에 따라 현무암이 덮개암으로도 역할을 할 수 있음을 시사한다.
Abstract
This study was to evaluate whether the basalt rock can serve as a caprock overlying a storage formation. For this study, geochemical modeling was applied to simulate CO2-basalt-water interactions at various CO2 partial pressures (10, 50, and 100 bar). The results showed that the pH was changed in four stages with time, and the formation of secondary minerals was controlled by the pH of the solutions. In the first stage (pH<8.8), Ca-Mg-Fe carbonate (dolomite, siderite, and ankerite) and clay (beidellite-Mg, saponite-Mg-Mg, saponite-Mg-Na, and beidellite-Na) were newly formed. In the second stage (pH=8.8), calcite and clay minerals (chlorite-Mg and chlorite-Fe) were formed and steadily increased, and zeolite (analcime) started to precipitate. In the third stage (8.8<pH<9.7), zeolite sharply increased, while calcite and clay minerals were nearly constant. In the last stage (pH=9.7), zeolite and clay minerals consistently increased, but calcite was constant. The precipitation of the secondary minerals decreased the porosity of the basalt rock by approximately 5.4% at 10 bar, 7.9% at 50 bar, and 10.1% at 100 bar CO2. The changes in the volume of the secondary minerals showed that the formation of clay minerals played a major role in reducing the porosity in all pH ranges. This result suggests that the basalt rock can act as a caprock as the porosity of the basalt rock decreased by CO2-basalt-water interactions.
Keywords:
basalt, CO2-basalt-water interaction, secondary mineral, porosity, caprock키워드:
현무암, CO2-현무암-물 반응, 2차 광물, 공극률, 덮개암1. 서 론
CO2 지중저장은 CO2 배출을 감소시킬 수 있는 유망한 기술로 간주된다(Bachu et al., 1994; IPCC, 2005). 대부분의 경우 대규모 점배출원에서 포집된 CO2 가스는 고갈된 오일 및 가스 저장소, 염수 대수층과 같은 퇴적층으로 주입되어 저장된다. 최근에는 현무암에 CO2를 주입하는 것이 주입된 CO2를 안정적인 탄산염 광물로 빠르게 저장할 수 있는 것으로 알려져 많은 주목을 받고 있다(McGrail et al., 2006; Matter et al., 2016). 현무암은 일반적으로 주요 광물이 감람석(olivine, Mg2SiO4-Fe2SiO4), 휘석(pyroxene, Mg2Si2O6-Fe2Si2O6-Ca2Si2O6) 및 사장석(plagioclase, NaAlSi3O8-CaAl2Si2O8)으로 구성되며, 이 광물들은 CO2가 풍부한 유체와 반응성이 매우 높은 것으로 알려져 있다(Matter et al., 2016). 따라서 현무암은 주입된 CO2를 Ca-Mg-Fe 탄산염 광물로 빠르게 전환할 수 있다. 예를 들어, CarbFix 프로젝트(https://www.or.is/carbfix)에서는 주입된 CO2의 95%가 2년 이내에 탄산염 광물로 변환되었다(Matter et al., 2016). Big Sky Carbon Sequestration Partnership (https://www.bigskyco2.org)의 현무암 소규모 주입 시범사업에서도 2년 후에 2차 탄산염 광물 생성이 관찰되었다(McGrail et al., 2017).
국내에서는 최근 대규모 해양 CO2 저장을 위한 부지 선정이 시급한 과제로 인식 되고 있다. 지구물리탐사 연구들에 따르면 3개의 분지(제주, 울릉, 군산)는 두껍고 젊은 쇄설 퇴적물로 구성되어있으며 잠재적인 CO2 저장소로 간주되고 있다(Kim et al., 2012; Lee et al., 2012; Shinn et al., 2020). 최근 Shin et al. (2020)에 따르면 남해 대륙붕(제주 분지 경계 부근) 지역에서는 퇴적층이 현무암층으로 덮여있다. 이들은 약 50 미터 두께의 현무암 지층이 해저면 아래 942 - 995 미터에 존재하며 약 88.44 km2의 면적에 걸쳐 있고, 현무암층 아래에는 저장층으로 판단되는 퇴적층이 200 미터 이상의 두께로 분포하고 있다고 보고하였다. 또한 이 퇴적층의 추정된 평균 CO2 저장 용량은 84.17 Mt이였고 초임계 CO2가 퇴적층에 주입 되면 현무암 지층이 덮개암으로 작용할 것으로 예상된다고 제안하였다. 따라서 본 연구의 목적은 현무암이 퇴적층(저장층) 상부에 존재하는 경우 현무암이 덮개암 역할을 할 수 있는지를 평가하는 것이다. 본 연구에서는 CO2 농도가 결정질 현무암의 변질에 미치는 영향을 모사하기 위해 CO2 분압(10 bar, 50 bar, 100 bar)의 구배에 따라 지구화학 배치(batch) 모델링을 이용하였다. 또한, 지구화학적 모델링 결과로부터 CO2-현무암-물 상호반응에 의한 공극률의 변화를 추정하였다. 이 연구는 CO2 지중저장에서 덮개암으로서의 현무암의 역할을 이해하는 데 도움이 될 것으로 기대된다.
2. 재료 및 방법
2.1 모델링 개념
우선 CO2가 저장층으로 주입 되면 CO2 주입으로 인한 압력 구배를 따라 지층을 통해 이동한다. 주입이 중단되면 CO2와 저장층 유체의 밀도 차이에 의해 CO2가 부유하여 덮개암 하부까지 이동하며, 이로 인해 주입정에서부터 CO2 플름을 따라 농도 구배를 형성한다. 또한 CO2 압력 구배는 CO2의 용해도를 결정하고 이에 따라 용해된 CO2에 의해 지층수는 산성화가 된다. 본 연구에서는 주입이 종료된 후 주입정(100 bar CO2) 인근에서부터 CO2 플름 경계부(10 bar CO2)까지 CO2 농도에 따라 CO2-현무암-물 상호반응을 개념적으로 모사하고자 하였다.
2.2 현무암 특성화
Shin et al. (2020)에 따르면 최근 지구물리탐사 및 3D 지질 모델링을 기반으로 남해 대륙붕(제주 분지 경계 부근) 지역 저장소의 저장 용량을 평가하였다. 그러나 시추공 로깅 데이터는 1983년 석유 조사를 위해 시추된 탐사 관정에서 얻을 수밖에 없었고 디지털화된 데이터만 사용가능하였다. 따라서 본 연구에서는 대안으로 제주도의 현무암과 인공 염수를 모델에 사용했다.
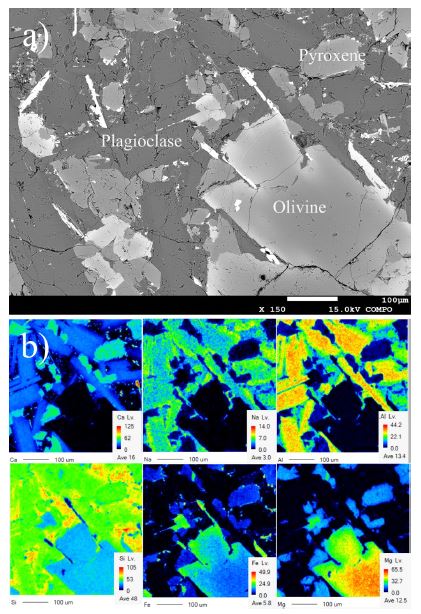
제주도 현무암 시료는 제주도에 위치한 채석장에서 구입하였다. 제주도 현무암은 Pliocene-Quaternary basaltic-trachytic 화산활동에 의해 형성된 것으로 알려져 있으며(Won, 1976), 제주도 표면의 대부분을 덮고 있고 높은 투수율 구조를 가지고 있다. 현무암의 주요 구성 광물들은 X선 회절(XRD)(Bruker, D8 ADVANCE A25)과 에너지 분산 분광법(EDS) (JEOL, JSM-7610F) 분석과 함께 주사 전자 현미경(SEM)으로 분석하였다. 또한 경상대학교 연구시설센터에서 파장 분산 분석(WDS)(JEOL, JXA-8530F PLUS)를 이용한 electron probe microanalysis(EPMA)를 활용하여 광물별 평균 화학성분을 분석하였다. 본 연구에서 XRD 분석 결과 현무암은 주로 사장석(69.0%), 휘석(26.8%), 감람석(3.8%)으로 구성되어 있는 것으로 나타났으며(표 1), 미량의 마그네사이트(magnesite)(0.4%)와 아날심(analcime)(0.2%)도 관찰되었다. 이러한 광물은 SEM(그림 1a)과 원소 매핑 이미지(그림 1b)에서도 관찰되었다. 감람석에는 Fe와 Mg가 풍부하고, 사장석에는 Ca, Na, Al이 풍부하고, 휘석은 Ca, Mg 및 Fe로 구성되어 있었다. 본 연구에서는 각 광물의 화학 조성을 EPMA 분석을 통해 계산하였다(표 1). 화학 조성은 관찰되는 각 광물의 여러 지점에서 EPMA 분석을 통해 평균값을 사용하였으며, 감람석 22개 지점, 사장석 21개 지점, 휘석 17개 지점에서 측정되었다. 평균 화학 조성은 감람석의 경우 Mg1.5Fe0.5SiO4, 사장석의 경우 Ca0.6Na0.4Al1.6Si2.4O8, 휘석의 경우 Ca0.24Mg0.54Fe0.22SiO3이었다.
현무암의 공극률과 표면적은 수은 관입 공극률 측정법(MIP)(Micromeritics, Autopore 9600)과 N2 흡착에 의한 Brunauer-Emmett-Teller (BET)(Micromeritics, 3Flex) 방법(Brunauer et al., 1938)으로 측정되었으며, 공극률은 15.85이고 표면적은 0.11 m2/g이었다.
2.3 지구화학적 모델링 절차
본 연구에서 지구화학적 모델링을 위한 초기 용액의 성분은 0.5M NaCl (해수와 유사)의 염수를 고려하였으며, 이어서 이 용액을 10, 50 및 100 bar CO2로 각각 평형 시켰다. 이때 온도는 지중 조건을 고려하여 50℃로 하였다. 생성된 개별 용액의 pH 값은 3.47, 3.15 및 3.06이었으며, 폐쇄된 탄산염 시스템에서 현무암과 반응속도론으로 반응시켰다. 이 조건은 주입 중단 후 CO2-현무암-물 상호반응을 모사하는 이 연구의 모델링 개념과 일치한다.
현무암의 반응속도론에 따른 용해를 모사하기 위해 PHREEQC 버전 3(Parkhurst and Appelo, 2013)을 사용하였으며, 데이터베이스는 Carbfix2 프로젝트에서 CO2-현무암-물 상호반응을 모사하기 위해 광물 용해도 및 화학 종들의 안정성을 수정한 carbfix. dat (Voigt et al., 2018)을 사용하였다(https://github.com/CarbFix/carbfix.dat). 이 데이터베이스는 core10. dat 데이터베이스(Neveu et al., 2017)를 기반으로 하고 있으며, Carbfix 프로젝트를 위해 18개의 제올라이트 그룹 광물이 carbfix.dat 데이터베이스에 추가되었으며, 철백운석의 열역학적 특성들이 데이터베이스에 통합되었고 돌로마이트와 능철석의 용해도는 다시 보정되었다(Voigt et al., 2018).
일반적으로 현무암의 주요 구성 광물들은 end member들로 구성된 고용체를 형성하고 있다. 이 연구에서 감람석은 EPMA 분석으로 얻은 화학 조성에 따라 75%의 포스테라이트(forsterite, Mg2SiO4)와 25%의 페이알라이트(fayalite, Fe2SiO4) 의 고용체로 간주 되었다(표 1). 같은 방법으로 사장석은 60%의 회장석(anorthite, CaAl2Si2O8)과 40%의 조장석(albite, NaAlSi3O8)으로 구성된 고용체로 조회장석(labradorite)과 유사하였다. 휘석은 54%의 엔스테타이트(enstatite, MgSiO3), 22%의 사철휘석(ferrosilite, FeSiO3), 24%의 규회석(wollastonite, CaSiO3)으로 구성된 사휘석(augite)에 가까웠다. 그러나 고용체의 반응속도론에 따른 용해는 PHREEQC 모델을 포함하는 지구화학 모델로는 계산이 불가능하다. 따라서 본 연구에서는 주요 구성 광물들의 반응속도론에 따른 용해는 end member 광물들을 이용하여 모사하였다(표 3). 또한 반응에 의해 새롭게 침전하는 2차 광물들은 현무암 지역에서 CO2 저장과 관련된 실험 연구(Gysi and Stefánsson, 2012; Menefee et al., 2018)와 지구화학적 모델링 연구(Gysi and Stefánsson, 2011; Aradóttir et al., 2012; Snæbjörnsdóttir et al., 2018) 결과들을 참조하여 선정하였다. 그러나 본 연구에서는 주요 구성 광물들에 칼륨(K)이 매우 미량이기 때문에 칼륨(K)을 포함한 2차 광물들은 제외하였다. 2차 광물 그룹은 표 2에 나와 있으며 염수가 각 광물들에 대해 포화 조건이 되면 모사하는 동안 침전되도록 허용하였다.
이 연구에서 광물의 용해/침전은 전이 상태 이론(Lasaga, 1998)을 기반으로 다음과 같은 수식으로 계산되었다.
| (1) |
여기서 i은 광물, r은 용해 속도(mol/s)(양수 값) 및 침전 속도(음수 값), k는 속도 상수(mol/m2/s), S는 광물의 표면적(m2), Q는 반응 지수, K는 평형 상수이다. 매개변수 θ와 η는 일반적으로 1로 간주된다. 광물의 용해 반응속도는 pH에 의존적이며 H+, H2O 및 OH- 에 의해 영향을 받는다. 전체 반응 속도는 개별 반응 메커니즘 속도의 합계이며 다음과 같이 계산된다(Brantley, 2008).
| (2) |
여기서 N, H, OH 는 각각 중성, 산 및 염기 메커니즘을 나타낸다. E는 활성화 에너지(J/mol), k25는 25℃에서 속도 상수(mol/m2s), R은 기체 상수(8.314 J/mol/K), T는 절대 온도(K), a는 이온 활동도, n은 거듭제곱 상수를 나타낸다. 본 연구에 사용된 각 광물에 대한 반응속도 변수 값들은 Palandri and Kharaka (2004)를 참조하였다(표 3). 사장석, 휘석, 감람석은 EPMA로 분석된 화학 조성을 고려하여 각각 조회장석, 사휘석, 포스테라이트의 용해 속도를 사용하였다.
광물들의 초기 표면적( Si )은 다음과 같이 계산되었다.
| (3) |
여기서 M과 m은 각각 광물 i의 분자량(g/mol)과 몰(mol) 농도이고, Xr은 전체 광물 표면적에 대한 비율이고, S는 전체 광물 표면적(m2)이다. 전체 광물 표면적(S)은 BET 측정으로부터 도출되었으며, 표면적의 분율(Xr)은 각 광물의 몰 분율에 비례하여 계산되었다. 반응 중 표면적의 변화는 광물의 초기 몰 농도(m0)와 주어진 시간에서 몰 농도(mt)의 비로부터 다음과 같이 계산하였다.
| (4) |
여기서 Si는 초기 표면적, mt는 시간 t에서의 몰 농도, m0은 광물의 초기 몰 농도이다.
주어진 시간(t)에서의 공극률도 다음과 같이 계산하였다.
| (5) |
여기서 ni는 광물 i의 몰 농도이고, vi는 광물 i의 몰 부피 이고, Vt는 총 부피를 나타낸다.
3. 결과 및 논의
3.1 pH와 2차 침전광물
CO2 농도에 따른 pH의 변화와 침전된 광물의 양은 그림 2에 제시하였으며, 침전된 광물의 양은 각 광물 그룹 내에서 침전된 개별 광물들의 몰의 합으로 나타내었다. 모든 CO2 농도 조건에서 pH는 현무암의 주요 구성 광물들(감람석, 사장석, 휘석)의 용해에 의해 반응 초기에 급격히 증가하였다. 또한 pH는 시간이 지남에 따라 4단계로 진화하는 것을 보여주었다(그림 2). 예를 들어, 10 bar CO2 (그림 2a)에서 pH는 첫 번째 단계에서 pH 8.8(pH < 8.8) 근처까지 급격히 증가하였다. 두 번째 단계에서 pH는 8.8 (pH = 8.8)로 일정하게 유지되었다. 세 번째 단계에서 pH는 다시 pH 9.7 근처까지 증가하고(8.8 < pH < 9.7), 마지막 단계에서 pH는 모사 시간 동안 9.7 (pH = 9.7)로 유지되었다. 즉, 평형에 도달한 것으로 보인다. 50 bar (그림 2b) 및 100 bar (그림 2c) CO2에서도 pH는 10 bar CO2와 마찬가지로 진화하지만 pH가 각 단계에 도달하는 데 더 오랜 시간이 걸리는 것을 볼 수 있었다. 100 bar CO2에서 pH는 10년 이내에 아직 마지막 단계(pH = 9.7)에 도달하지 않는 것을 볼 수 있었다.
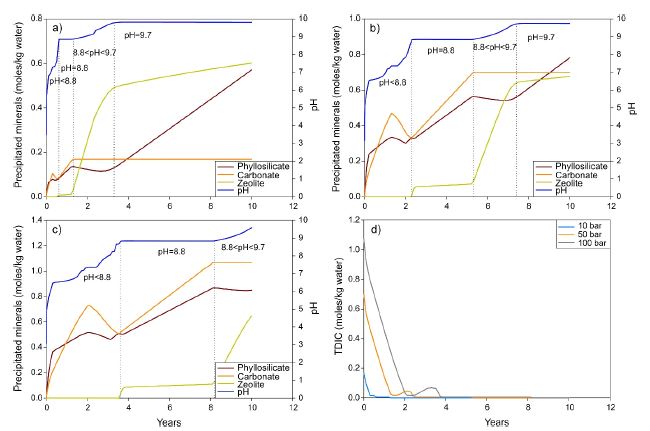
The evolution of pH and the secondary groups based on (a) 10 bar CO2, (b) 50 bar CO2, and (c) 100 bar CO2 and (d) the change in total dissolved inorganic carbon (TDIC) with the CO2 partial pressure.
그림 2는 또한 pH의 변화가 시간에 따른 2차 광물의 형성과 밀접한 관련이 있음을 보여주고 있었다. 모든 CO2 농도 조건에서 첫 번째 단계(pH < 8.8)에서는 탄산염과 층상규산염(phyllosilicate) 광물이 새로 생성되었다. 두 번째 단계(pH = 8.8)에서는 탄산염과 층상규산염의 농도가 꾸준히 증가하고 제올라이트가 침전되기 시작하였다. 세 번째 단계(8.8 < pH < 9.7)에서 제올라이트의 농도는 급격히 증가하는 반면 탄산염과 층상규산염의 농도는 거의 일정해졌다. 마지막 단계(pH = 9.7)에서 제올라이트와 층상규산염의 농도는 지속적으로 증가하지만 탄산염의 농도는 일정한 것을 볼 수 있었다. 이러한 결과는 2차 광물의 형성이 각 단계의 pH 변화와 관련이 있음을 보여주고 있다. 또한 CO2 농도가 증가함에 따라 침전된 탄산염 광물의 농도가 증가하는 것을 볼 수 있었다. 즉, pH > 8.8에서 침전된 탄산염의 최대량은 10 bar CO2에서 0.17 moles/kg, 50 bar CO2에서 0.64 moles/kg, 100 bar CO2 에서 1.07 moles/kg이었다(그림 2a, 2b, 2c). 이 침전양은 용액(그림 2d)에서 총 용존 무기 탄소(TDIC, CO2(aq) + HCO3- + CO32-)의 초기 농도와 일치하며, 이는 주어진 CO2 분압에서 CO2 용해도에 따른 CO2 용해에 기인한다. 이러한 TDIC는 급격히 감소하여 대부분 2년 이내에 소모되며(그림 2d), 이는 용해된 CO2가 탄산염 광물로 완전히 전환되었음을 나타낸다. 이것은 또한 침전된 탄산염의 양이 pH > 8.8에서 일정한 이유이기도 하다.
3.2 2차 침전광물에 대한 CO2의 영향
탄산염 광물은 깊은 지층에 영구적으로 CO2를 저장할 수 있기 때문에 CO2 지중 저장에서 중요한 관심의 대상이다. 따라서 CO2 농도에 따른 탄산염 광물의 형성은 그림 3a, 3b, 3c에 제시하였다. 우선 pH < 8.8에서는 돌로마이트와 능철석가 형성되고 철백운석이 침전되기 시작하였다. pH = 8.8에서는 철백운석 서서히 용해되면서 방해석이 형성되기 시작하였다. pH > 8.8에서는 유일하게 방해석만 침전되었다. 이러한 결과는 탄산염 광물(즉, Ca-Mg-Fe 탄산염 광물)이 반응 초기부터 형성될 수 있음을 보여주고 있으며, calcite는 pH 8.8 이상에서 주로 침전되는 것을 나타내고 있다.
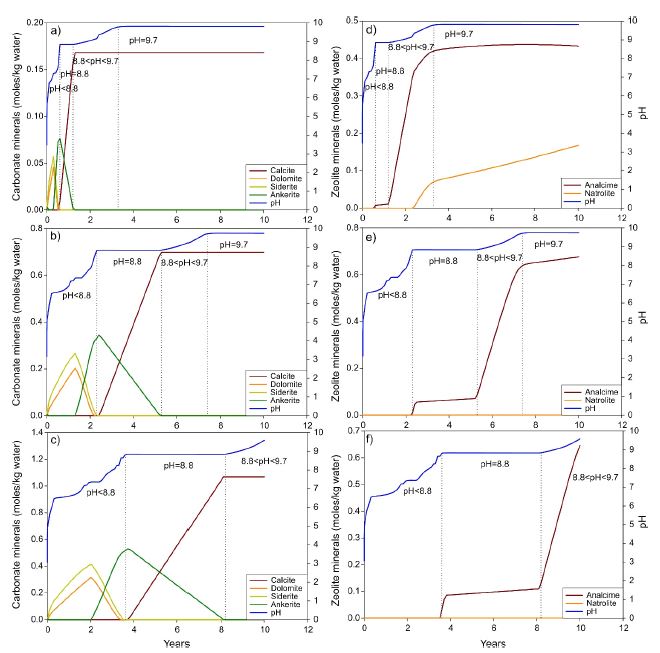
The evolution of pH and carbonate minerals based on (a) 10 bar CO2, (b) 50 bar CO2, and (c) 100 bar CO2. The evolution of pH and zeolite minerals based on (d) 10 bar CO2, (e) 50 bar CO2, and (f) 100 bar CO2.
CO2 농도에 따른 제올라이트 광물의 생성은 그림 3d, 3e 및 3f에 제시하였다. 그림에서 보이는 것과 같이 아날심은 pH = 8.8에서 소량으로 침전되기 시작하지만 pH > 8.8에서는 그 양이 급격히 증가하였다. 반면 나트롤라이트(natrolite)는 pH > 8.8에서 낮은 CO2 분압(10bar)에서만 형성되었다(그림 3d).
그림 4에는 CO2 농도에 따른 층상규산염 광물의 변화를 나타내었다. 그림에서 보이는 것과 같이 점토 광물 3종(바이델라이트-Mg, 사포나이트-Mg-Mg, 사포나이트-Mg-Na)은 pH < 8.8에서만 형성되었다. 한편, 바이델라이트-Mg와 사포나이트-Mg-Mg가 사라진 후 바이델라이트-Na는 pH < 8.8에서 침전되기 시작하여 pH = 8.8에서 꾸준히 증가하였다. 이 바이델라이트-Na는 8.8 < pH < 9.7에서 감소하지만 pH = 9.7에서 지속적으로 증가하였다. 그림 4에서는 또한 pH = 8.8 부근에서 녹니석-Mg와 녹니석-Fe가 생성되어 지속적으로 증가하는 것을 볼 수 있었으며, 녹니석-Mg는 pH > 8.8에서 더 빠르게 상승하였다. 대조적으로, 안티고라이트(antigorite)는 소량 생성되었다. 이러한 결과는 pH = 8.8 및 pH > 8.8에서 바이델라이트-Na, 녹니석-Mg 및 녹니석-Fe가 층상규산염의 주요 2차 광물임을 보여주고 있다.
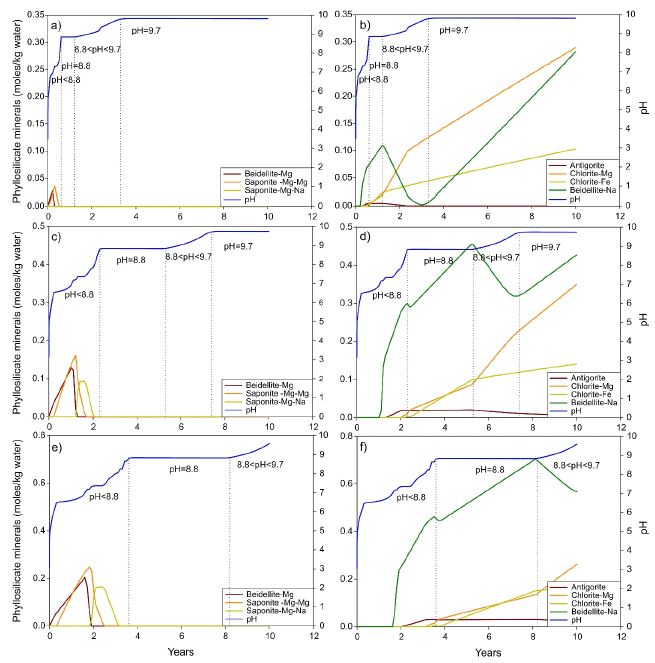
The evolution of pH and phyllosilicate minerals based on (a) and (b) 10 bar CO2, (c) and (d) 50 bar CO2, and (e) and (f) 100 bar CO2, respectively.
요약하면, 본 연구의 모델링 결과는 CO2-현무암-물 상호반응에 의한 2차 광물의 형성이 용액의 pH를 조절하는 것을 보여주었으며, pH < 8.8에서 Mg-Na-점토 및 Ca-Mg-Fe 탄산염 광물이 우세하였다. 그러나 pH = 8.8에서 Mg-Fe-점토, 방해석 및 제올라이트 광물이 형성되기 시작하여 pH가 증가할수록 우세하게 되었다. 다른 연구자들의 실험 및 모델링 연구들도 유사한 결과를 보여주었다(Gudbrandsson et al., 2011; Gysi and Stefánsson, 2011; Gysi and Stefánsson, 2012; Snæbjörnsdóttir et al., 2018). 예를 들어, 주요 광물의 함량, 물의 화학적 조성의 차이에도 불구하고, Gysi and Stefánsson (2012)은 40℃에서 260일 동안 CO2-현무암-물 상호반응에 대한 저온 실험을 수행하였다. 그들은 Fe가 풍부한 탄산염과 Ca-(Mg)-Fe 스멕타이트(smectite)가 pH < 5.5에서 형성되는 반면 방해석와 제올라이트 및 Mg가 풍부한 점토는 pH > 6.5에서 우세하다는 것을 보여주었다. 그들의 다른 연구(Gysi and Stefánsson, 2011)에서는 Fe가 풍부한 탄산염과 점토(Ca-Fe 스멕타이트)는 pH < 6.5에서 침전된 반면 방해석과 제올라이트 및 점토(Mg-Fe 스멕타이트)는 pH > 8에서 우세하게 침전하였다. Snæbjörnsdóttir et al. (2018)의 Carbfix 사이트에서 반응 이동 모델링 연구도 비슷한 결과를 보여주었다. 또한 위의 연구 결과들에 따르면 탄산염 광물을 구성하는 Ca, Mg, Fe는 점토와 제올라이트 광물들 형성시에도 소모되기 때문에 탄산염 광물 생성은 점토와 제올라이트 광물 생성에 의해 제한될 수 있음을 시사했다. 본 연구의 모델링 결과 또한 Mg-점토(예: 바이델라이트-Mg 및 사포나이트-Mg-Mg)와 Mg-Fe-점토 광물(Mg-Fe-녹니석)의 생성 pH 범위에 따라 Mg 및 Fe에 대해 탄산염 광물과 경쟁할 수 있음을 시사하고 있다.
3.3 공극률 변화
주요 광물의 용해 및 2차 광물의 침전은 현무암 암석의 공극률을 증가시키거나 감소시킬 수 있다. 본 연구에서 CO2 농도에 따라 현무암 변질에 기인하는 공극률 변화가 그림 5a에 제시되었다. 그림에서 보이는 것과 같이 모든 CO2 분압 조건에서 현무암의 공극률이 감소하였으며, CO2 분압이 높을수록 공극률 감소도 증가하였다. 즉, 공극률은 10bar CO2에서 약 5.4%, 50 bar CO2에서 7.9%, 100 bar CO2에서 10.1% 감소하였다. 또한 투수율의 상대적인 변화는 아래 power-law로와 같은 공극률-투수율 관계식으로 부터 유추가 가능하다.
| (6) |
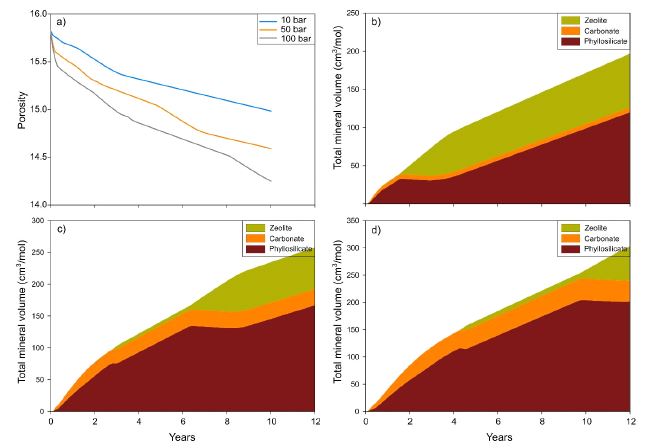
(a) The change in porosity of the basalt rock. The change in mineral volume of the secondary mineral groups based on (b) 10 bar CO2, (c) 50 bar CO2, and (d) 100 bar CO2.
여기서 ki와 φi는 초기 투수율과 공극률을 나타내며, η는 지수로 이 값이 3인 경우는 cubic law로 잘 알려져 있다(Xu et al., 2012). 이 η값은 또한 일반적으로 3에서 75의 범위 값을 갖으며, 대부분 9에서 20의 범위 값을 갖는 것으로 알려져 있다(Brunet et al., 2013). Bernabé et al. (2003)은 다양한 물리/화학적 작용과 매질에 따라 이 값을 2.5에서 25의 범위에서 값을 갖는 것으로 보고하였다. 하지만 η은 실험을 통해 결정되어야 하고 이를 통해 모델과 일치시켜야 한다.
본 연구에서는 우선 cubic law (η= 3)를 적용하여 투수율 변화를 계산해보았다. 왜냐하면 cubic law는 균열 매질에 적용될 수 있는 것으로 알려져 있기 때문에(Steefel and Lasaga, 1994), 현무암에 적합할 것으로 판단하였다. 이 cubic law는 일정한 간극(aperture)을 가진 평행한 균열 면에서의 흐름을 가정하기 때문에, 균열 면을 따라 균등하게 광물 침전이 발생하는 것을 의미한다. 하지만 Schaef et al. (2011)의 CO2-현무암-물 상호반응 실험 결과에서처럼 불연속적으로 방해석 침전물이 균열 면에 발생하거나, 균열 간극을 가로질러 광물이 침전하는 경우에는 공극률의 변화가 적더라도 투수율을 크게 감소시킬 수도 있다(Wu et al., 2021). 따라서, Wu et al. (2021)의 경우처럼 η값을 증가시키면서 이때 공극률 감소에 따라 투수율의 변화를 계산하였으며 그림 6에 제시하였다. 여기에서는 초기 투수율을 모르기 때문에 투수율은 초기 투수율에 대한 변화된 투수율 비(k/ki)로 나타내었다. 그림 6에서 보이는 것과 같이 η값이 증가함에 따라 투수율 비가 급격히 낮아짐을 볼 수 있다. Cubic law의 경우 공극률 감소에 따라 투수율 감소 비율이 가장 낮게 나타나고 있으며, 공극률이 10% 감소하면 투수율 비는 약 0.7이고 공극률이 20% 감소하면 투수율 비는 약 0.5 정도가 된다. 반면 η이 25인 경우에는 공극률 감소가 10%에 도달하기 전에 투수율 비는 0.1 보다 낮아지게 된다. 따라서 η값이 커질수록 2차 광물의 침전에 의해 현무암의 밀폐 능력 향상으로 CO2 누출을 방지할 수 있을 것으로 판단된다. 또한 Wu et al. (2021)의 균열 현무암을 대상으로 한 모델링 결과에 따르면 투수율 감소가 적더라도 유체의 유동 속도를 감소시켜 광물 침전을 증진시키고 이는 다시 투수율을 감소시킴으로서 자가 치유 시스템(self-healing system)을 형성할 수 있을 것으로 제안하였다. 하지만 앞으로 이와 관련된 다양한 실험과 현장 연구가 요구된다.
이러한 공극률과 투수율의 감소는 점토 및 제올라이트 같은 부피가 큰 광물의 형성에 기인하며, 각 광물 그룹의 부피의 합은 그림 5b, 5c 및 5d에 나타내었다. 그림에서 보이는 것과 같이 광물 부피 총 합의 증가(즉, 공극률 감소)는 주로 층상규산염과 제올라이트 광물 생성에 기인하고, 탄산염 광물은 매우 작은 비율을 차지한다는 것을 보여주고 있다. 하지만 제올라이트 광물은 CO2 농도가 증가함에 따라 감소하는 반면(그림 5c, 5d), 탄산염 및 층상규산염 광물의 비율은 증가하였다. 이러한 결과는 CO2 분압이 증가할수록 층상규산염(주로 점토 광물)의 형성이 공극률 감소의 주요 요인임을 보여주고 있다.
3.4 CO2 지중저장에 대한 시사
덮개암의 존재는 저장소에서 CO2 누출 방지를 위해서 중요한 저장소 선택 기준 중 하나로, 일반적으로 이암, 점토, 셰일과 같이 낮은 투과도를 가지고 있는 암석으로 대표된다(Griffith et al., 2011). 하지만 McGrail et al. (2006)은 Columbia River flood Basalt (Wallula, Washington, USA)의 파일럿 CO2 저장 프로젝트에서 고밀도 저투과성 현무암 암석이 효과적인 덮개암 역할을 할 수 있을 것으로 제안하였다. 또한 Wu et al. (2021)은 현무암에 발달된 균열에서 탄산염와 점토 광물들의 침전에 의해 공극률과 투수율이 감소함을 반응성 용질이동 모델링을 통해 보여주었다. 본 연구의 모사 결과도 점토와 제올라이트 광물의 형성으로 인해 현무암의 공극률이 감소한다는 것을 보여주었다. 특히, 점토 광물은 CO2농도가 높은 조건(즉, 상대적으로 낮은 pH)에서도 공극률 감소의 주요 원인이었다. 덮개암의 밀봉 능력은 공극률을 포함한 고유한 특성에 따라 달라지며(Griffith et al., 2011), 공극률의 변화에 의해 평가될 수 있다(Gaus et al., 2005). 따라서 본 연구 결과는 공극률 감소로 인해 현무암의 밀봉 능력이 증가할 수 있고, 현무암이 퇴적층을 덮고 있는 지역에서 덮개암 역할을 할 수 있음을 시사한다.
3.5 연구의 한계점
현무암의 주요 광물은 둘 이상의 end member로 구성된 고용체이다. 또한 2차 광물(탄산염, 층상규산염, 제올라이트 광물)도 다성분 고용체를 형성한다. 그러나 이러한 고용체 광물은 복잡하고 비이상적인 조성으로 인해 열역학 데이터가 부족하다. 현재 PHREEQC (Parkhurst and Appelo, 2013) 및 TOUGHREACT (Xu et al., 2006)와 같은 지구화학적 코드는 이러한 고용체를 모사하는데 동일한 제한이 있다. 또한 지구화학적 모델링의 결과는 주요 구성 광물 조성 및 반응 표면적, 유체 화학, 반응속도 상수 및 2차 광물과 같은 입력 변수의 영향을 받을 수 있다. 특히 반응속도 상수 및 생성될 수 있는 2차 광물들은 실험을 통해 측정되고 이를 통해 모델링 결과를 검증해야 한다. 이러한 한계에도 불구하고, 이 연구는 CO2 농도에 따라 CO2-현무암-물 상호반응의 결과를 추적하는 데 도움이 될 수 있을 것으로 판단된다. 하지만 모델링 결과를 검증하고 지구화학적 모델링을 개선하기 위해 추후 실험적 연구가 수행되어야 할 것이며, 다상유동 반응성 용질 이동 모델링을 통해 CO2 유동에 따른 현무암 변질 연구가 필요할 것으로 보인다.
4. 결 론
이 연구는 CO2 농도가 CO2-현무암-물 상호반응에 영향을 미친다는 것을 보여주었으며, 2차 광물의 형성은 용액의 pH와 연관되어있음을 보여주었다. 모델링 결과는 Mg-Na-점토 및 Ca-Mg-Fe 탄산염 광물이 pH < 8.8에서 우세한 광물종인 반면 Mg-Fe 점토, 방해석 및 제올라이트 광물은 pH = 8.8에서 형성되기 시작하여 pH 증가와 함께 우세한 광물종이 되는 것을 보여주었다. 이러한 결과는 층상규산염 광물(점토)이 pH 범위에 따라 Mg 및 Fe에 대해 탄산염 광물과 경쟁 관계일 수 있음을 시사한다. 또한 본 연구의 모델링 결과 점토 광물이 모든 pH 범위에서 총 광물 부피의 증가에 지배적인 기여를 하고 있기 때문에 현무암 암석의 공극률 감소에 영향을 줄 수 있음을 나타낸다.
Acknowledgments
본 연구는 한국지질자원연구원(KIGAM)에서 수행한 “CO2 지중저장소 저장효율 향상 및 안전성 평가 기술 개발(22-3413)” 사업의 지원을 받아 수행되었습니다.
References
-
Aradóttir, E.S.P., Sonnenthal, E.L. and Jónsson, H., 2012, Development and evaluation of a thermodynamic dataset for phases of interest in CO2 mineral sequestration in basaltic rocks. Chemical Geology, 304-305, 26-38.
[https://doi.org/10.1016/j.chemgeo.2012.01.031]

-
Bachu, S., Gunter, W.D. and Perkins, E.H., 1994, Aquifer disposal of CO2: hydrodynamic and mineral trapping. Energy Conversion and Management, 35, 269-279.
[https://doi.org/10.1016/0196-8904(94)90060-4]

-
Bernabé, Y., Mok, U. and Evans, B., 2003, Permeability-porosity relationships in rocks subjected to varioius evolution processes. Pure and Applied Geophysics, 160, 937-960.
[https://doi.org/10.1007/978-3-0348-8083-1_9]

-
Brantley, S.L., 2008, Kinetics of mineral dissolution, In: Brantley, S.L., Kubicki, J.D., White, A.F. (Eds.), Kinetics of Water-Rock Interaction. Springer Verlag, New York, p. 151-210.
[https://doi.org/10.1007/978-0-387-73563-4_5]

-
Brunauer, S., Emmett, P.H. and Teller, E., 1938, Adsorption of gases in multimolecular layers. Journal of the American Chemical Society, 60, 309-319.
[https://doi.org/10.1021/ja01269a023]

-
Brunet, J.P.L., Li, L., Karpyn, Z.T., Kutchko, B.G., Strazisar, B. and Bromhal, G., 2013, Dynamic evolution of cement composition and transport properties under conditions relevant to geological carbon sequestration. Energy Fuels, 27, 4208-4220.
[https://doi.org/10.1021/ef302023v]

- Intergovernmental Panel of Climate Change (IPCC), 2005, Carbon Dioxide Capture and Storage. IPCC Special Report. Cambridge University Press, New York, 431 p.
-
Gaus, I., Azaroual, M. and Czernichowski-Lauriol, I., 2005, Reactive transport modelling of the impact of CO2 injection on the clayey cap rock at Sleipner (North Sea). Chemical Geology, 217, 319-337.
[https://doi.org/10.1016/j.chemgeo.2004.12.016]

-
Griffithe, C.A., Dzombak, D.A. and Lowry, G.V., 2011, Physical and chemical characteristics of potential seal strata in regions considered for demonstrating geological saline CO2 sequestration. Environmental Earth Science, 64, 925-948.
[https://doi.org/10.1007/s12665-011-0911-5]

-
Gudbrandsson, S., Wolff-Boenisch, D., Gislason, S.R. and Oelkers, E.H., 2011, An experimental study of crystalline basalt dissolution from 2 ≦ pH ≦11 and temperatures from 5 to 75℃. Geochimica et Cosmochimica Acta, 75, 5496-5509.
[https://doi.org/10.1016/j.gca.2011.06.035]

-
Gysi, A.P. and Stefánsson, A., 2011, CO2-water-basalt interaction. Numerical simulation of low temperature CO2 sequestration into basalts. Geochimica et Cosmochimica Acta, 75, 4728-4751.
[https://doi.org/10.1016/j.gca.2011.05.037]

-
Gysi, A.P. and Stefánsson, A., 2012, CO2-water-basalt interaction. Low temperature experiments and implications for CO2 sequestration into basalts. Geochimica et Cosmochimica Acta, 81, 129-152.
[https://doi.org/10.1016/j.gca.2011.12.012]

-
Kim, Y., Lee, K., Jo, S., Kim, M., Kim, J.S. and Park, M.H., 2012, A preliminary evaluation on CO2 storage capacity of the southwestern part of Ulleung Basin, offshore, East Sea. Economic and Environmental Geology, 45, 41-48 (in Korean with English abstract).
[https://doi.org/10.9719/EEG.2012.45.1.041]

-
Lasaga, A.C., 1998, Kinetic theory in the earth sciences. Princeton University, Princeton, 811 p.
[https://doi.org/10.1515/9781400864874]

-
Lee, G.H., Lee, B., Yi, B.Y., Lee, K., Park, M.H., Kim, H.J. and Yoo, H.S., 2012, Estimation of the CO2 storage capacity of the structural traps in the southern Jeju Basin, offshore southern Korea, northern East Chia Sea. Geosciences Journal, 16, 313-326.
[https://doi.org/10.1007/s12303-012-0026-3]

-
Matter, J.M., Stute, M., Snæbjörnsdottir, S.Ó., Oelkers, E.H., Gislason, S.R., Aradottir, E.S., Sigfusson, B., Gunnarsson, I., Sigurdardottir, H., Gunnlaugsson, E., Axelsson, G., Alfredsson, H.A., Wolff-Boenisch, D., Mesfin, K., Taya, D.F.D., Hall, J., Dideriksen, K. and Broecker, W.S., 2016, Rapid carbon mineralization for permanent disposal of anthropogenic carbon dioxide emissions. Science, 352, 1312-1314.
[https://doi.org/10.1126/science.aad8132]

-
McGrail., B.P., Schaef, H.T., Ho, A.M., Chien, Y.-J., Dooley, J.J. and Davidson, C.L., 2006, Potential for carbon dioxide sequestration in flood basalts. Journal of Geophysical Research: Solid Earth, 111.
[https://doi.org/10.1029/2005JB004169]

-
McGrail, B.P., Schaf, H.T., Spane, F.A., Cliff, J.B., Qafoku, O., Horner, J.A., Thompson, C.J., Owen, A.T. and Sullivan, C.E., 2017, Field validation of supercritical CO2 reactivity with basalts. Environmental Science and Technology Letters, 4, 6-10.
[https://doi.org/10.1021/acs.estlett.6b00387]

-
Menefee, A.H., Giammar, D.E. and Ellis, B.R., 2018, Permanent CO2 trapping through localized and chemical gradient driven basalt carbonation. Environmental Science and Technology, 52, 8954-8964.
[https://doi.org/10.1021/acs.est.8b01814]

-
Neveu, M., Desch, S.J. and Catillo-Rogez, J.C., 2017, Aqueous geochemistry in icy world interiors: Equilibrium fluid, rock, and gas compositions, and fate of antifreezes and radionuclides. Geochimica et Cosmochimica Acta, 212, 324-371.
[https://doi.org/10.1016/j.gca.2017.06.023]

-
Palandri, J.L. and Kharaka, Y.K., 2004, A compilation of rate parameters of water-mineral interaction kinetics for application to geochemical modeling: USGS Open File Report 2004-1068, Menlo Park, California, National Energy Technology Laboratory-United States Department of Energy, 64 p.
[https://doi.org/10.3133/ofr20041068]

-
Parkhurst, D.L. and Appelo, C.A.J., 2013, PHREEQC (Version 3)-A Computer Program for Speciation, Batch-Reaction, One-Dimensional Transport, and Inverse Geochemical Calculations. Model Tech., B6.
[https://doi.org/Rep.99-4259]

-
Schaef, H.T., McGrail, B.P. and Owen, A.T., 2011, Basalt reactivity variability with reservoir depth in supercritical CO2 and aqueous phases. Energy Procedia, 4, 4977-4984.
[https://doi.org/10.1016/j.egypro.2011.02.468]

- Shin, S.Y., Kang, M., Shin, Y.J. and Cheong, S., 2020, Assessment of CO2 geological storage capacity for basalt flow structure around PZ-1 exploration well in the Southern Continental Shelf of Korea. Economic and Environmental Geology, 53, 33-43 (in Korean with English abstract).
-
Shinn, Y.J., Lee, H.S., Lee, Y., Song, I. and Park, M.H., 2020, 3D grid based screening process for large-scale CO2 geological storage in Gunsan Basin, Yellow Sea, Korea. International Journal of Greenhouse Gas and Control, 99, 103062.
[https://doi.org/10.1016/j.ijggc.2020.103062]

-
Snæbjörnsdóttir, S.Ó., Gislason, S.R., Galeczka, I.M. and Oelkers, E.H., 2018, Reaction path modeling of in-situ mineralization of CO2 at the CarbFix site at Hellisheidi, SW-Iceland. Geochimica et Cosmochimica Acta, 220, 348-366.
[https://doi.org/10.1016/j.gca.2017.09.053]

-
Steefel, C.I. and Lasaga, A.C., 1994, A coupled model for transport of multiple chemical species and kinetic precipitation/dissolution reactions with application to reactive flow in single phase hydrothermal system. American Journal of Science, 294, 529-592.
[https://doi.org/10.2475/ajs.294.5.529]

-
Voigt, M., Marieni, C., Clark, D.E., Gislason, S.R. and Oelkers, E.H., 2018, Evaluation and refinement of thermodynamic databases for mineral carbonation. Energy Procedia, 146, 81-91.
[https://doi.org/10.1016/j.egypro.2018.07.012]

- Won, C.K., 1976, Study of petro-chemistry of volcanic rocks in Jeju Island. Journal of the Geological Society of Korea, 12, 207-226 (in Korean with English abstract).
-
Wu, H., Jayne, R.S., Bodnar, R.J. and Pollyea, R.M., 2021, Simulation of CO2 mineral trapping and permeability alteration in fractured basalt: Implications for geologic carbon sequestration in mafic reservoirs. International Journal of Greenhouse Gas Control, 109, 103383.
[https://doi.org/10.1016/j.ijggc.2021.103383]

-
Xu, T., Sonnenthal, E., Spycher, N. and Pruess, K., 2006, TOUGHREACT-A simulation program for non-isothermal multiphase reactive geochemical transport in variably saturated geologic media: application to geothermal injectivity and CO2 geological sequestration. Computers and Geosciences, 32, 145-165.
[https://doi.org/10.1016/j.cageo.2005.06.014]

- Xu, T., Spycher, N., Sonnenthal, E., Zheng, L. and Pruess, K., 2012, TOUGHREACT user’s guide: a simulation program for non-isothermal multiphase reactive transport in variable saturated geologic media, version 2.0. Report LBNL-DRAFT. Lawrence Berkeley National Laboratory, Berkeley.