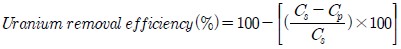Phytoextraction using citric acid for enhanced removal of uranium from soil
The objective of this research is to investigate the uranium (U) removal efficiencies of the phytoextraction with the addition of citric acid as a reagent for the naturally uranium contaminated soil. Four different plants such as lettuce (Lactuca sativa L.), Chinese cabbage (Brassica campestris L.), sweet potato (Ipomoea batatas L.), and radish (Raphanus sativus L.) were cultivated for 49 days in a phytotron using plastic pots (30 cm × 10 cm × 11 cm) containing 3.3 kg of U contaminated soil. As a chelating agent, 300 ml of 25 mM (or 50 mM) citric acid solution was added into the soils. Leaves and roots of the plant were collected after 49 days of cultivation and their uranium concentrations were analyzed using an ICP/MS to calculate the removal efficiency (%) and the removal amount (㎍) per each plant. When the citric acid solution was not used, U concentrations in roots and leaves of lettuce were 404.48 ㎍/kg and 3.45 ㎍/kg for Duckpyeong soil (initial U concentration: 28.85 mg/kg), indicating that the most of uranium extracted from the soil were accumulated in roots. Among the four plants used in this study, the lettuce roots showed the highest U concentration, and the roots of chinese cabbage, sweet potato and radish in order. With 50 mM citric acid solution, U concentration of leaves and roots increased by 10~50 times and 3~10 times, compared to those without citric acid solution, suggesting that the use of 50 mM citric acid solution as a chelating agent is very effective in enhancing the U removal from the soil. Only 14% of U in exchangeable/carbonate fractions were removed by the phytoextraction when the citric acid was not used. But nearly 100% of U were removed when 50 mM citric acid solution was added to the soil. Results suggested that the addition of citric acid to the soil can increase the solubility of U attached on the carboxyl group of citric acid in soil water and thus accelerate the biological activity of the plant, following the increase of U transition capacity into the plant.
초록
국내 대표 재배 식물과 구연산(citric acid)을 이용한 식물추출법(phytoextraction)의 효과를 정량적으로 검증하기 위하여, 우라늄 함량이 높은 것으로 보고된 옥천대 흑색 셰일층과 점판암이 기반암인 금산군 추부지역과 괴산군 덕평지역의 토양을 사용하여 식물추출법 실험을 수행하였다. 본 연구에서는 우라늄 제거효과에 대한 선행 연구가 거의 없고 성장속도가 빠른 식물 중에서 국내에서 흔히 재배되는 상추(lettuce: Lactuca sativa L.), 배추(Chinese cabbage: Brassica campestris L.), 고구마(sweet potato: Ipomoea batatas L.), 무(radish: Raphanus sativus L.) 등 총 4종을 사용하였다. 오염토양 3.3 kg을 채운 식물재배 포트(30 cm × 10 cm × 11 cm)에 각 식물들을 식재한 후, 식물 성장기(온도 25℃, 습도 70%, 조도 4000 Lux (16 시간/일), CO2 농도 600 ppm 유지)에서 49일 동안 재배하였으며, 재배시간별로 채취한 잎과 뿌리의 우라늄 농도를 분석하여 식물추출법에 의한 우라늄 제거량과 제거효율을 계산하였다. 구연산(citric acid)를 첨가하지 않은 식물추출법 실험결과 식물체에서 우라늄은 대부분이 뿌리에 농축되었고, 잎으로의 전이량은 매우 낮았다. 특히 네 종류 식물 중 상추 뿌리가 우라늄 농축 농도(덕평토양: 404.48 ㎍/kg)뿐 아니라 제거량도 가장 높았고(덕평토양: 1179.47 ㎍), 그 다음은 배추, 고구마, 무 순이었다. 실험 결과, 식물체에 농축되는 우라늄 양은 토양 내 용출 가능한 우라늄량(특히 교환성/탄산염형태로 존재하는 우라늄량)에 비례하는 것으로 나타났다. 토양으로부터 식물로의 우라늄 흡수율을 높이기 위하여 첨가제로 25 mM과 50 mM 구연산용액을 식물 수확 6일 전에 각각 300 ml씩 주입하여 식물추출법 실험을 수행한 결과, 50 mM 구연산용액을 첨가한 경우 구연산용액을 첨가하지 않은 경우보다 식물 우라늄 농도는 잎은 최소 10배에서 최대 50배, 뿌리는 최소 3배에서 최대 10배까지 증가하여, 우라늄 흡수율을 높이기 위한 첨가제로 50 mM 구연산용액을 사용하는 것이 매우 효과적인 것으로 나타났다. 구연산용액을 첨가하지 않은 식물추출법의 경우, 초기 우라늄 농도가 높은 덕평토양 내 교환성/탄산염결합 형태로 존재하는 우라늄량의 14%를 제거할 수 있었으나, 50 mM 구연산용액을 첨가한 경우 토양 내 교환성/탄산염결합 형태로 존재하는 우라늄량을 100% 제거할 수 있었다. 이러한 결과는 구연산용액의 첨가가 토양에 존재하는 우라늄의 용해도를 증가시켜 용존 우라늄이 구연산의 카르복실기와 결합하여 식물로 쉽게 이동하고, 식물체의 생물활성도를 증가시켜 식물체 내 우라늄 전이량을 증가시키기 때문으로 판단된다.
Keywords:
citric acid, phytoextraction, uranium, removal capacity, soil pollution, 구연산, 식물추출법, 우라늄, 제거량, 토양오염1. 서 론
에너지의 대부분을 수입하고 있는 우리나라는 원자력 발전에 필요한 핵연료를 위해 연간 500 ton 정도의 농축 우라늄을 100% 전량 수입하고 있는 실정이며, 에너지 소비량도 매년 10% 이상씩 늘어나고 있다(Korea Hydro and Nuclear Power, 2013). 현재 국내 4개 지역(울진, 월성, 고리, 영광)에서 가동되고 있는 23기 원전으로 부터 매년 새롭게 발생하는 사용 후 핵연료만도 약 13,000다발에 달하나, 고준위 방사성폐기물을 위한 원전 내 임시저장소는 오는 2016년 고리원전을 시작으로 2018년 월성원전, 2019년 영광원전, 2021년 울진원전 순으로 포화 상태가 되어 2024년 이후에는 완전히 포화될 전망이다(Korea Hydro and Nuclear Power, 2013). 토양과 지하수는 방사성폐기물 저장/처리방법의 특성상 방사능핵종(radionuclide)에 의해 오염되기 쉬운 매체로 여겨지고 있으며, 대부분의 원전에서 우라늄은 가장 심각한 방사능 오염물질 중 하나이다(Saling and Fentiman, 2001). 원자력 발전시설 가동이나 방사성폐기물 처리 과정 중 냉각수의 유출 또는 방사성폐기물 침출수 등에 의해 주변 토양이나 지하수가 오염될 가능성이 있고, 2011년 3월 일본 후쿠시마 원전폭발 사고와 같이 지진과 쓰나미에 의한 자연재해에 의해서도 방사능핵종이 자연으로 유출될 가능성이 높다. 또한 각국의 핵실험에 의한 낙진에 의해서도 토양과 지하수가 오염될 수 있다. 자연발생에 기원한 방사능핵종에 의한 토양과 지하수 오염에 대한 연구는 매우 저조하였으나, 선행 연구에 의하면 우리나라는 지질학적으로 우라늄을 함유한 광상이 여러 지역에서 나타나고 있으며, 우라늄 광상을 포함하는 기반암 상부에 존재하는 토양의 우라늄 농도도 높게 나타나 자연발생적인 우라늄 오염토양이 광범위하게 분포하는 것으로 알려져 있다(Lee and Chon, 1980; Kim et al., 1986; Chon et al., 1997).
우라늄으로 오염된 토양을 정화하는 물리·화학적 처리방법으로는 토양세척법, 고형화/안정화법, 동전기법, 열탁착법 등이 있지만, 이러한 방법들은 정화시간을 단축할 수 있는 반면 고비용이며 환경파괴적인 요소를 가질 뿐 아니라 2차 오염물질이 발생할 수 있는 단점도 가지고 있어서(Kunit et al., 2001), 최근에는 식물을 이용한 생물학적인 처리방법이 많이 연구되고 있다. 식물의 기능을 이용하여 토양을 정화하는 식물정화법(phytoremediation)은 생태계의 복원과 예방이 동시에 가능하며 경제적이고 친환경적인 복원방법으로 알려져 있다(Schnoor et al., 1995; US EPA, 1999a; Igwe and Abia, 2006). 식물정화법에는 식물기능을 이용하여 토양 내 중금속을 제거하는 식물추출법(phytoextraction)과 식물의 뿌리를 이용하여 지하수 내 우라늄을 흡착-흡수하는 뿌리여과법(rhizofiltration)이 가장 많이 활용되고 있으며(Gatliff, 1994; Macek et al., 2000; Reeves and Baker, 2000; Antonkiewicz and Jasiewicz, 2002), 이외에도 식물의 뿌리를 이용하여 토양입자가 유실되지 못하게 토양층에 고정시켜 중금속의 이동성을 제한하여 안정화시키는 식물안정화법(phytostabilization)과 활성화된 근권 미생물에 의한 수경분해법(rhizodegradation) 등이 있다(Simonich and Hites, 1995; Schnoor, 1998; Ghosh and Singh, 2005).
식물추출법의 중금속 제거기작은 식물의 뿌리를 통해 토양으로 부터 중금속을 흡수하고, 이를 줄기나 잎 등으로 이동시켜 식물체 내에 무독한 중간물질로 변환시키는 과정을 포함한다. 이 과정에서 중금속은 양이온 형태로 식물 뿌리 세포의 원형질막에 흡착되여 목질부로 전이된 후 식물체의 세포층 내에서 유기화합물로 킬레이트된다. 식물의 중금속 흡착은 토양의 pH, 산화/환원 환경 등에 대하여 의존적이며, 다른 중금속 농도와 착화합물을 형성하는 리간드 등에 의해서도 영향을 받을 수 있다(Pabalan and Turner, 1997; Katsoyiannis et al., 2006). 식물추출법의 중금속 제거효율은 유전공학 적용(Dhankher et al., 2002), 미생물 활성화(Souza et al., 1999), 비료나 킬레이트제(Bennett et al., 1998; Huang et al., 1998) 등의 첨가에 의해 향상될 수 있는데, 킬레이트제는 주로 식물이 중금속을 흡착하고 전이하기 위한 토양의 중금속 용해도와 생물활성도를 증가시키는 첨가제로 사용되어왔다(Schmidt, 2003). 식물추출법에 주로 사용된 킬레이트제는 ethylene diamine tetracetic acid (EDTA: C10H16N2O8), ethylene dia-mine diacetate (EDDA: C6H16N2O4), 구연산(citric acid: C6H8O7) 등이 있는데(Kumar et al., 1995; Huang and Cunningham, 1996; Brooks, 1998; Salt et al., 1998), 특히 Huang (1998)은 구연산을 사용하여 토양 내 우라늄의 용해도와 생물활성도를 증가시켜 식물의 우라늄 흡수율을 높일 수 있다고 주장하였다. Chang et al. (2005)은 구연산용액 30 mM 200 ml를 우라늄 오염 토양에 주입했을 때 유채와 인도 겨자에 의한 우라늄 흡수율이 크게 증가한다고 하였고, Duquène et al. (2009)은 여러 종류의 킬레이트제 중 구연산을 사용하였을 때 인도겨자와 호밀풀에 의한 우라늄 흡수율이 가장 많이 증가한다고 하였으며, Mihalik et al. (2012)은 구연산 사용에 의해 해바라기에 의한 우라늄(U), 철(Fe), 아연(Zn)의 흡착율이 증가한다고 하였다. 불행히도 국내 우라늄 농도가 높은 토양의 상당부분이 농경지로 활용되고 있으나, 이들 농경지 대표 재배 작물에 대한 우라늄 농도나 농축능(accumulation capacity)에 대한 연구는 아직까지 이루어진바 없으며, 토양으로부터 이러한 작물에 의해 제거되는 우라늄량에 대한 정량적인 연구도 수행된 적이 없다.
본 연구에서는 우라늄 농도가 높은 국내 토양과 대표 재배 작물을 대상으로 구연산용액을 첨가한 식물추출법의 제거효율과 제거기작을 실내 실험을 통하여 규명함으로써, 향 후 우라늄 오염토양 복원을 위한 구연산용액을 첨가한 식물추출법의 적용 가능성을 입증하고자 하였다.
2. 실험 방법 및 내용
2.1 토양의 물리·화학적 특성 규명
옥천대 내 흑색 셰일층과 점판암이 기반암이며 이전 연구자들에 의해 우라늄 함량이 높은 것으로 확인된 충북 괴산군 덕평리(Shin and Kim, 2011), 보은군 용촌리(Lee et al., 1996), 금산군 추부지역(Kim and Chon, 1997)의 산과 밭 토양 9지점에서 채취한 토양시료 중에서, 작물 재배가 가능한 밭 토양 중 우라늄 농도가 가장 높은 덕평지역 토양(이하 ‘덕평토양(DP soil)’으로 명명)과 농도가 가장 낮은 추부지역 토양(이하 ‘추부토양(CB soil)’으로 명명)을 본 연구의 실험대상 토양으로 선정하였다(그림 1).
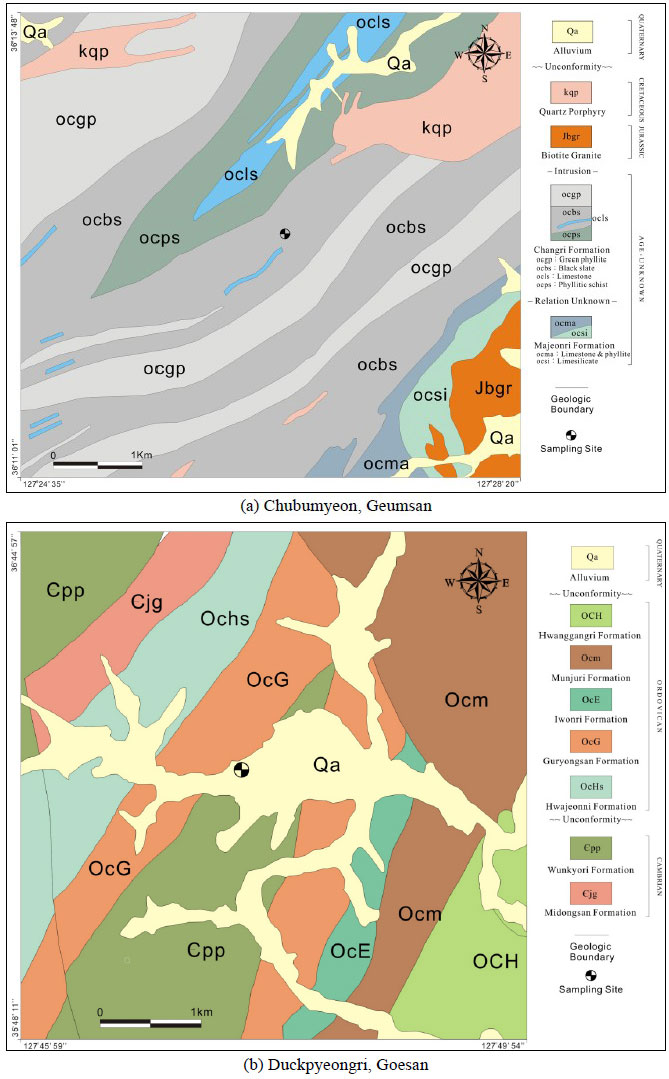
Geological maps around the soil sampling sites (modified from Lee et al., 1980 (a) and Lee et al., 1972 (b)).
추부토양과 덕평토양의 물리·화학적 특성을 파악하기 위하여 토성(Soil texture), 수소이온 농도(pH), 총유기탄소함량(TOC: Total Organic Carbon content), 양이온교환능력(CEC: Cation Exchange Capacity), 총질소(T-N) 및 총인(T-P)량, X-선회절(XRD: X-ray Diffractometer), X-선형광(XRF: X-ray Fluorescence spectrometer) 분석을 실시하였다. 토양의 토성을 분석하기 위하여 암석과 불순물을 제거한 후 30℃에서 건조하였으며, 토양 입도 분포량 측정은 입도가 모래입자 이상의 경우 자동체분석기를 사용하였다. 미사와 점토입자의 경우 1000 ml 메스실린더에 200 mesh 크기 이하의 토양과 5% 칼곤(Na2PO7)용액 1 L를 혼합한 후, 토양입자의 크기에 따른 침강속도차를 이용하는 피펫팅(pipetting)법을 이용하여 측정하였다(Moon, 1996). 토양시료의 입도 분석 결과를 토대로 미농무성에서 제시한 토성삼각법(soil texture triangle)으로 토성을 결정하였다. 토양의 수소이온농도(pH)는 국내 토양오염공정시험법에 따라 토양 시료를 증류수와 1 : 5(W/V)로 혼합하여 1시간 정치시킨 후 pH 전극(Orion 3-Star Plus pH Meter)을 이용하여 측정하였다. 총유기탄소함량, 양이온교환능력, 총질소, 총인의 농도는 서울대학교 농생명과학공동기기원(NICEM)에 분석을 의뢰하였다. 토양의 주원소성분 분석을 하기 위하여 분말상태의 토양 시료(200 mesh 크기 이하)를 유리비드(glass bead)에 성형한 후, X-선 형광분석기(SHIMADZU-1800)를 이용하여 주원소 성분을 분석하였다. 토양의 주 구성 광물을 분석하기 위하여 X-선 회절분석기(Phlips, Metheland, X’ Pert-MPD System)를 이용하여 분석하였다.
채취한 두 토양시료에 대하여 2013년 토양공정시험법에서 제시한 왕수추출법인 전함량법으로 전처리하여 ICP-MS (Perkin elmer, Elan 6100, FIMS 400)로 우라늄 농도를 측정하였다. 채취한 토양을 25℃에서 자연 건조시켜 100번체로 각각 체질한 후 토양 3 g을 정확히 취하여 250 ml 반응 용기에 넣고 약 0.5~1 ml의 물로 적셔 준 다음 염산 21 ml와 질산 7 ml를 가하여 섞어주었다. 흡수 용기에 질산(0.5 M) 15 ml를 붓고 2시간 동안 정치 후 온도를 70~100℃로 올려 환류조건에 도달하도록 한 다음 2시간 동안 분해한 후 반응용기의 상등액을 Whatman NO. 40 여과지를 사용하여 100 ml 둥근 플라스크에 여과하고 질산 0.5 M 용액으로 표선까지 채운 여액의 우라늄 농도를 ICP-MS로 분석하였다.
2.2 연속추출 실험
토양에 존재하는 모든 우라늄을 식물이 흡수할 수 있는 것은 아니므로 우라늄이 토양 내에서 어떤 화학적 형태로 존재하는가를 규명할 필요가 있으며, 우라늄의 존재형태를 파악함으로써 우라늄의 생물학적 흡수가능 정도를 예측할 수 있다(Kim and Fergusson, 1991). 본 연구에서는 토양 내 존재하는 우라늄 형태와 형태별 존재량을 측정하기 위하여 Tessier et al. (1979)가 제시한 방법으로 두 토양시료에 대하여 연속추출 실험(SEP: Sequential extraction procedure)을 실시하였다. 연속추출 실험에 의해 토양 내 우라늄의 존재 형태는 5단계로 분류될 수 있으며, 토양으로부터 용출이 쉬운 순서대로 교환성이온형태(1단계), 탄산염형태(2단계), 환원성 철/망간산화물형태(3단계), 산화성 유기물/황화물형태(4단계), 광물격자 내 잔류상형태(5단계)로 분류한다. 각 단계별 연속추출액에 의한 우라늄 용출량을 전체 우라늄 함량과 비교하여 토양 내 5종류의 존재 형태별 우라늄의 질량비를 계산하였다. 자세한 연속추출 실험방법은 Jung (1994)의 논문에 나타나있다.
2.3 식물추출법(phytoextracton) 실험
국내 대표 식물을 이용하여 식물추출법에 의한 식물의 우라늄 제거량을 규명하는 식물재배포트(pot) 실험을 실시하였다. 식물은 우라늄 제거효과에 대한 선행 연구가 거의 없으며, 중금속 흡착율이 높고 성장속도가 빠른 식물 중에서, 국내 10대 재배 작물에 포함되는 상추(lettuce: Lactuca sativa L.), 배추(Chinese cabbage: Brassica campestris L.), 고구마(sweet po-tato: Ipomoea batatas L.), 무(radish: Raphanus sativus L.) 등 총 4종을 사용하였다(그림 2). 식물추출법 실험을 위해 30 cm × 10 cm × 11 cm 크기의 직사각형 플라스틱 포트를 사용하였으며, 원활한 배수를 위하여 포트 하부를 마사토를 이용하여 약 1 cm 두께로 채우고, 그 위에 우라늄 농도가 다른 자연 건조된 추부토양과 덕평토양을 포트별로 3.3 kg씩 충진하였다. 포트별 동일종의 식물이 식재되었으며, 식물 종류별로 2개씩 총 16개의 식물 재배 포트를 제작하였다. 상추, 배추, 무는 각각의 포트에 씨앗을 심어 발아시켰으며, 고구마는 알고구마의 싹을 틔운 후 포트에 이식하여 재배하였다. 포트마다 증류수를 매일 100~300 ml씩 공급하여 전체 토양 수분 함량이 약 20~30%가 유지되도록 조절하였다. 식물성장기(phytotron)의 조건을 온도 25℃, 습도 70%, 조도 4000 Lux (16시간/일), CO2농도 600 ppm으로 유지한 후 식물포트를 식물성장기 내에 정치시켜 작물들을 49일 동안 재배하였으며, 재배한 식물은 2주 간격으로 총 4회 채취하였다. 식물추출법을 이용한 작물 재배 실험 과정은 그림 3에 나타내었다.
식물추출법에 의해 식물 내에 농축된 우라늄량을 측정하기 위해 채취한 식물은 잎과 뿌리를 분리하여 잎은 증류수로 3번 세척하였고, 뿌리는 흙을 털어낸 후 증류수로 세척한 후 다시 0.1% HClO4 용액에 3분 동안 담근 뒤 증류수로 3번 이상 세척하였다(Chang, 2005). 습식분해법(NIAST, 2000)에 따라 분리한 식물 부위별 시료 2 g을 300 ml 비이커에 넣고 10 ml 질산(HNO3)을 첨가하여 10시간 정치시켰다. 갈색 연기가 모두 날아 갈 때까지(유기물 분해) 1 ml 과산화수소수(H2O2)를 추가하여 180℃ 이하에서 1차 산분해를 실시한 후, 최종 분해액인 ternary solution (HNO3 : H2SO4 : HClO4=10 : 1 : 4), 20 ml를 첨가하여 무색이 될 때까지 160℃~200℃에서 서서히 가열하였다. 0.5% 질산을 사용하여 최종 분해액의 부피를 10 ml로 맞춘 후 Whatman No. 40 여과지를 사용하여 여과한 여액의 우라늄 농도를 ICP-MS로 측정하여 재배 시간에 따른 식물의 부위별 우라늄 농도를 분석하였다. 각 포트 내 토양 3.3 kg에서 재배한 식물의 무게와 식물의 우라늄 농도를 곱하여 부위별 우라늄 농축량을 결정하였고, 토양과 식물체 사이의 질량분배율로부터 식물추출법에 의한 식물별 우라늄 제거효율(uranium removal efficiency:%)을 아래 식을 이용하여 계산하였다.
여기서, Cs는 토양의 초기 우라늄 농도(㎍/kg)를 나타내고, Cp는 식물추출법 실험 후 식물에 농축된 우라늄의 농도(㎍/kg)를 나타낸다.
식물추출법에 의한 토양으로부터 우라늄(+6)이온의 식물 농축은 토양의 우라늄 존재 형태와 착화합물을 형성하는 리간드 등에 의해서도 영향을 받으며(Pabalan et al., 1997; Katsoyiannis et al., 2006), 산성환경에서는 주로 UO22+의 ‘우라닐’ 양이온 형태로 존재하여 용해성이 큰 탄산염 착화합물(carbonate complex) 등을 형성함으로써 토양 내에서 우라늄의 용해도(solubility)와 이동도(mobility)를 증가시키는 것으로 알려져 있다(Waite et al., 1994; Langmuir, 1997). 본 연구에서는 토양으로부터 식물로의 우라늄 농축률을 높이기 위한 킬레이트제로 구연산용액을 토양에 첨가하여 식물의 우라늄 농축능을 증가시키는 실험을 실시하였다. 토양은 우라늄 함량이 높은 덕평토양을 사용하였고, 식물은 앞선 실험과 동일한 상추, 배추, 고구마, 무 등 총 네 종류를 사용하여 식물 성장 최적인 온도 25℃, 습도 70%, 조도 4000 Lux (16시간/일), CO2 농도 600 ppm 조건의 식물성장기에서 56일 동안 재배하였다. 구연산용액은 Lozano et al. (2011)의 기존 연구에 의해 효과가 높은 것으로 알려진 25 mM과 50 mM을 사용하였다. 식물 수확 6일 전에 25 mM과 50 mM 구연산용액 300 ml씩을 토양 상부층에 분사하는 방식으로 식물 재배 포트에 각각 주입하였다. 재배 시간에 따라 채취한 식물은 앞 장에서 설명한 습식분해법으로 전처리한 후 ICP-MS로 식물 부위별 우라늄 농도를 분석하였다.
3. 연구 결과
3.1 토양의 물리·화학적 특성 규명
실험에 사용한 토양의 물리․화학적 특성 분석 결과는 표 1에 나타내었다. 추부토양의 토성은 직경이 0.075 mM를 초과하는 sand 입자 비율이 86.90%, 0.075 mM 이하인 silt입자와 clay입자 비율이 각각 10.96%와 2.13%인 ‘양질사토(Loamy sand)’였으며, 덕평토양은 sand입자가 91.12%, silt입자는 5.22%, clay입자가 3.66%를 차지하는 ‘사토(Sand)’에 해당되었다. 추부토양의 pH는 7.66으로 중성 토양이었고 TOC는 3.13%, CEC는 21.74 cmol/kg, 총질소량은 0.25%이었다. 덕평토양의 pH는 5.43으로 약산성 토양이었고 TOC는 2.12%, CEC는 17.20 cmol/kg, 총질소량은 0.14%이었다. 두 토양의 TOC, CEC, 총질소량은 비슷하게 나타났지만 총인량은 추부토양이 2790.33 mg/kg으로 덕평토양 556.22 mg/kg보다 높게 나타났다. 두 토양의 주성분분석 결과, 추부토양은 SiO2 66.16%, Al2O3 16.36%, Fe2O3 5.55%, K2O 0.25%, MgO 2.64%순으로 이루어져 있었으며, 덕평토양도 SiO2가 68.02%로 대부분을 차지하고, Al2O3 16.48%, Fe2O3 6.38%, K2O 3.54%, MgO 2.44% 순으로 이루어져 있었다. 두 지역 토양의 주구성광물 분석 결과, 추부토양과 덕평토양 모두 석영, 백운모, 녹니석이 주구성광물인 것으로 나타났다(Han, 2014). 우라늄 농도 분석 결과, 식물 재배가 가능한 토양 중에서 우라늄 함량이 28.85 mg/kg으로 가장 높은 충북 괴산군 덕평리 밭토양과 우라늄 함량이 4.53 mg/kg으로 가장 낮은 충남 추부지역의 밭 토양을 본 실험을 위한 토양시료로 선정하였다.
3.2 연속추출 실험
추부토양과 덕평토양 내 우라늄 존재형태를 파악하기 위한 연속추출 실험 결과는 표 2에 나타내었다. 추부토양의 경우 1단계(교환성형태) 우라늄 농도는 0.80 ㎍/kg, 2단계(탄산염형태)는 52 ㎍/kg, 3단계(환원성 철/망간산화물형태)는 13,258 ㎍/kg, 4단계(산화성 유기물/황하물형태)는 4,370 ㎍/kg, 5단계(광물격자 내 잔류상형태)는 1,612 ㎍/kg으로 분석 되어, 추부토양 내 전체 우라늄의 97%가 안정된 형태인 3단계(46%), 4,단계(22%), 5단계(29%)로 존재하였고, 전체 우라늄의 3%(53.65 ㎍/kg)만 식물이 흡수하기 쉬운 1단계와 2단계 형태로 토양 내에 존재하였다. 덕평토양의 1단계(교환성형태) 우라늄 농도는 7.61 ㎍/kg, 2단계(탄산염형태)는 2,970.67 ㎍/kg, 3단계(환원성 철/망간산화물형태)는 13,258 ㎍/kg, 4단계(산화성 유기물/황하물형태)는 4,370 ㎍/kg, 5단계(광물격자 내 잔류상형태)는 1,612 ㎍/kg으로 분석되어, 덕평토양 내 87%의 우라늄이 토양 내 안정된 형태인 3단계(60%), 4단계(20%), 5단계(7%)로 존재하였고, 전체 우라늄의 13.4%(2,978 ㎍/kg)가 식물이 흡수하기 쉬운 1단계와 2단계 형태로 토양 내에 존재하였다.
3.3 식물추출법(pytoextraction) 실험
추부토양과 덕평토양을 대상으로 상추, 배추, 고구마, 무 등 네 종류의 식물을 식물성장기에서 49일 동안 재배시킨 식물을 재배일자 별로 그림 4에 나타내었다. 씨앗을 발아시킨 경우 발아 3일 후부터 싹이 트기 시작하여 1주 후에는 모든 식물이 1 m 이상 성장하였고, 5주 후부터는 급격히 성장하여 7주 후에는 생체량이 급격히 증가하였다. 두 종류 토양에 대하여 식물 성장 속도는 비슷하였고 재배한 식물의 생체량 또한 비슷하였다. 식물 재배 과정에서 식물의 뿌리는 식물이 성장하는 과정 중에 있어서 재배 시간별로 채취하여 분석하지 못하였고(재배 종료 후 채취), 식물 잎 만 2주 간격으로 총 4회(1, 3, 5, 7주) 채취하여 우라늄 농도를 분석하였다. 재배 시간별 채취한 식물 잎과 뿌리의 우라늄 농도는 표 3에 나타내었다. 덕평토양에서 발아 후 1주된 식물 잎의 우라늄 농도는 상추가 121.73 ㎍/kg으로 가장 높았으며, 그 다음은 배추 65.06 ㎍/kg, 무 19.99 ㎍/kg, 고구마 4.19 ㎍/kg 순이었고, 3주 후부터는 상추가 29.49 ㎍/kg, 배추 17.10 ㎍/kg, 고구마 1.65 ㎍/kg, 무는 2.67 ㎍/kg으로 낮아졌으며, 7주 후에는 상추가 3.45 ㎍/kg, 배추 10.21 ㎍/kg, 고구마 2.15 ㎍/kg, 무 3.99 ㎍/kg으로, 모든 식물 잎의 우라늄 농도가 10 ㎍/kg 이하로 낮았다. 토양의 우라늄 농도에 상관없이 모든 종류의 식물 잎은 발아 후 1주 이내에 우라늄 농도가 가장 높았고, 재배 3주 이후부터는 급격히 감소하여 매우 낮게 유지하였다. 이러한 결과는 1주 후부터 식물의 생체량이 급격히 증가(식물 질량 증가)하지만 식물의 우라늄 농축능은 일정하게 유지(단위 질량당 우라늄 농축량은 오히려 감소)되어 식물의 생체량 증가에 비해 식물의 우라늄 농도는 더 이상 크게 증가하지 않기 때문이다. 따라서 식물추출법을 토양 내 우라늄 제거를 위해 활용하는 경우 가급적 식물 재배 시간을 줄이되 재배 횟수를 증가하는 방법을 선택하는 것이 바람직할 것으로 판단되었다.
추부 토양(초기농도: 4.53 mg/kg)에서 49일 동안 재배한 후 채취한 식물 뿌리의 농도는 상추가 47.73 ㎍/kg으로 가장 높았고 그 다음이 배추 21.76 ㎍/kg, 고구마 19.73 ㎍/kg, 무 19.49 ㎍/kg 순이었으며, 식물 잎의 우라늄 농도보다 식물 뿌리의 농도가 훨씬 높았다. 덕평토양(28.85 mg/kg)의 경우 식물 뿌리 농도는 추부토양과 마찬가지로 상추가 404.48 ㎍/kg으로 가장 높았고 그 다음이 배추 326.38 ㎍/kg, 고구마 315.72 ㎍/kg, 무 206.81 ㎍/kg 순이었다. 실험 결과로부터 식물체에서 우라늄은 대부분 뿌리에 흡착되었고 잎으로는 매우 적은 양이 전이되었음을 알 수 있었다. 두 종류 토양에서 재배한 식물 중 상추 뿌리의 우라늄 농도가 가장 높았고 그 다음이 배추, 고구마, 무 순이었다. 토양의 우라늄 농도가 상대적으로 높은 덕평토양(초기농도: 28.85 mg/kg)에서 재배한 모든 식물 잎과 뿌리의 우라늄 농도가 상대적으로 낮은 추부토양(초기농도: 4.53 mg/kg)에서 재배한 식물 잎과 뿌리의 농도보다 높게 나타나, 식물체의 우라늄 농도는 토양의 우라늄 농도(특히 교환성/탄산염형태(연속추출 1단계와 2단계)로 존재하는 우라늄 농도)에 비례하는 것으로 나타났다(앞의 3.2 결과 내용 참조).
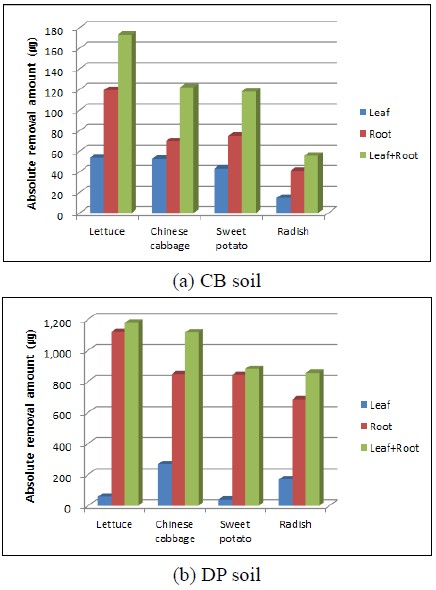
추부토양과 덕평토양에서 49일 동안 재배하여 채취한 식물 잎과 뿌리의 우라늄 농도에 잎과 뿌리의 건조 중량을 곱하여 계산한 식물 부위별 우라늄 절대제거량(absolute removal amount: ㎍)을 그림 5에 나타내었다. 추부토양(초기농도: 4.53 mg/kg)에서 재배한 후 채취한 상추 잎의 우라늄 제거량은 53.63 ㎍으로 가장 높았으며, 그 다음 배추 52.42 ㎍, 고구마 43.11 ㎍, 무 14.58 ㎍ 순이었다. 식물 뿌리의 우라늄 제거량 역시 상추가 119.33 ㎍으로 가장 높았고, 그 다음이 배추 69.63 ㎍, 고구마 74.97 ㎍, 무 40.93 ㎍ 순이었다(그림 5(a)). 추부토양으로 부터 식물추출법에 의한 식물의 총 우라늄 제거량은 상추가 172.95 ㎍으로 가장 높았고, 그 다음이 배추 122.05 ㎍, 고구마 118.08 ㎍, 무 55.51 ㎍ 순이었다. 덕평토양(초기농도: 28.85 mg/kg)에서 재배한 후 채취한 식물 잎의 우라늄 제거량은 상추의 경우 59.06 ㎍으로 가장 낮았고, 배추가 268.491 ㎍으로 가장 높았으며, 고구마는 39.45 ㎍, 무는 170.48 ㎍이었다(그림 5(b)). 뿌리의 우라늄 제거량은 추부토양과 마찬가지로 상추가 1120.41 ㎍으로 가장 높았고, 그 다음이 배추 848.58 ㎍, 고구마 842.96 ㎍, 무 686.61 ㎍ 순이었다. 덕평토양으로부터 식물추출법에 의한 식물의 총 우라늄 제거량은 상추가 1179.47 ㎍으로 가장 높았고 그 다음이 배추 1117.07 ㎍, 고구마 882.42 ㎍, 무 857.09 ㎍ 순이었다. 실험 결과, 토양의 우라늄 농도에 관계없이 식물의 총 우라늄 제거량은 상추가 가장 높았고 그 다음 배추, 고구마, 무 순이었다. 우라늄 농도가 낮은 추부토양보다 농도가 높은 덕평토양에서 재배한 모든 식물의 우라늄 제거량이 높게 나타났으며, 잎과 뿌리의 우라늄 제거량비도 덕평토양에서 높게 나타나, 식물체에 흡수된 우라늄량이 증가할수록 다른 부위보다 뿌리에 농축되는 우라늄량도 증가하는 것으로 나타났다. 추부토양의 경우 49일 동안 상추 재배에 의해 토양 1 kg으로부터 제거된 우라늄량은 식물 농축 가능한 총 우라늄량(연속추출에 의해 토양으로부터 추출된 1단계와 2단계로 존재하는 우라늄량) 대비 93%이었고, 덕평토양의 경우 상추를 이용한 1회 식물추출법에 의해 토양 1kg으로부터 제거된 우라늄량은 14%에 불과해 최대 우라늄 농축률을 나타내는 상추를 이용하여 식물추출법으로 덕평토양의 우라늄을 제거하는 경우라도 수 차례 작물 재배가 필요할 것으로 판단되었다.
초기 우라늄 농도가 높은 덕평토양으로 부터 식물의 우라늄 흡수율을 높이기 위한 킬레이트제로 구연산 25 mM과 50 mM 용액을 식물추출법 종료 6일 전에 각 식물 포트에 300 ml씩 주입하여 식물 재배 실험을 한 후, 토양의 특성을 분석한 결과는 표 4에 나타내었다. 구연산 25 mM과 50 mM 용액 주입은 토양의 총유기탄소함량(TOC), 양이온교환능력(CEC), 총질소량, 총인량 값에는 큰 영향을 주지 않은 것으로 나타났으나, 토양 pH는 구연산 25 mM 용액을 첨가 했을 때 4.95로 감소하였고, 50 mM 용액 첨가에 의해 4.79로 감소하였다. 이러한 결과는 우라늄이 pH 5 이하 산성 조건에서는 주로 UO22+와 같은 우라늄(+6)의 ‘우라닐’ 양이온 형태로 존재하는데(Grenthe et al., 1992), 토양 내 주입된 구연산이 토양 내 ‘우라닐’ 양이온과 반응하여 금속킬레이트 복합체로 존재함으로써 토양으로부터 우라늄의 용해도와 생물활성도를 증가시키기 때문으로 판단되었다(Huang et al., 1998).
토양의 우라늄 흡수율을 높이기 위한 킬레이트제로 구연산 25 mM과 50 mM 용액 첨가하여 수행한 식물추출법 종료 후 식물 잎과 뿌리의 우라늄 농도 분석 결과는 그림 6에 나타내었다. 구연산 25 mM 용액을 주입한 덕평토양에서 재배한 식물 잎의 우라늄 농도는 고구마가 164.26 ㎍/kg으로 가장 높았고, 다음으로 상추 95.19 ㎍/kg, 무 73.32 ㎍/kg, 배추 67.88 ㎍/kg 순이었으며, 식물 뿌리의 우라늄 농도는 배추가 949.03 ㎍/kg으로 가장 높았고, 다음으로 상추 553.90 ㎍/kg, 고구마 544.69 ㎍/kg, 무 325.74 ㎍/kg 순이었다(그림 6(a)). 구연산 25 mM 용액을 첨가한 토양에서 재배된 식물 잎의 우라늄 농도는 상추가 95.19 ㎍/kg으로 구연산용액을 첨가하지 않은 토양에서 재배한 상추 잎(3.45 ㎍/kg)과 비교했을 때 30배 이상 높게 나타나, 네 종류 식물 잎 중 가장 많이 증가하였다. 25 mM 구연산용액을 첨가한 토양에서 재배된 식물 뿌리의 우라늄 농도는 배추가 949.03 ㎍/kg으로 구연산용액을 첨가하지 않은 토양에서 재배한 배추(326.38 ㎍/kg)보다 약 3배 증가하여 네 종류 식물 뿌리 중 가장 증가율이 높았다(그림 6(b)). 구연산 50 mM 용액을 첨가한 토양에서 재배한 식물 잎의 우라늄 농도는 배추가 500.83 ㎍/kg으로 구연산용액을 첨가하지 않은 토양에서 재배한 배추(10.21 ㎍/kg) 보다 약 50배 증가하여 네 종류 식물 잎 중 가장 많이 증가하였다. 구연산용액을 첨가한 토양에서 재배한 식물 뿌리의 우라늄 농도는 무가 구연산용액을 첨가하지 않은 토양에서 재배한 무보다 10배 이상 증가하여 네 종류 식물 뿌리 중 가장 많이 증가하였다. 실험 결과, 토양으로부터 식물로의 우라늄 농축율을 높이기 위한 킬레이트제로 50 mM의 구연산용액을 사용하는 것이 효과적인 것으로 나타났고, 특히 배추는 50 mM 용액을 첨가했을 때 잎(429.43 ㎍/kg)과 뿌리(2913.68 ㎍/kg)의 우라늄 농도가 가장 많이 증가하였다. 구연산용액 첨가에 의해 잎의 우라늄 농도가 많이 증가하는 것은 식물 뿌리에만 흡착되었던 우라늄이 구연산 분자구조(C6H8O7) 내 3개의 카르복실기(R-COO-)와 결합하여 킬레이트 화합물을 형성하고, 식물체의 세포층으로 이동한 후, 세포벽의 카르복실기(COO-)와 결합하여 흡착하였기 때문인 것으로 판단된다(Waite et al., 1994; Langmuir, 1997).
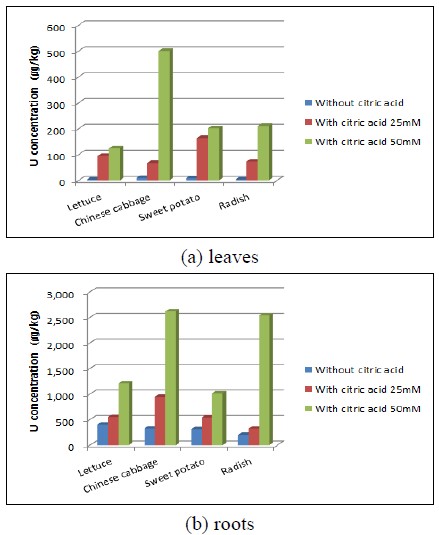
Uranium concentrations in leaves (up) and roots (down) of plant for 7 weeks of phytoextraction with/without citric acid solution.
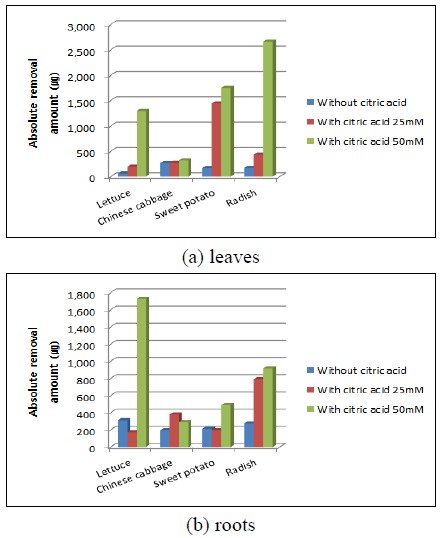
구연산 25 mM과 50 mM 용액을 첨가한 후 식물추출법을 수행한 식물 잎과 뿌리의 총 우라늄 절대제거량 계산 결과는 그림 7에 나타내었다. 구연산 50 mM 용액을 주입한 토양에서 재배한 식물 잎의 우라늄 제거량은 무가 2661.97 ㎍으로 가장 높았으며, 그 다음 고구마 1746.75 ㎍, 상추 1293.24 ㎍, 배추 320.53 ㎍이었다. 식물 뿌리의 우라늄 제거량은 상추가 1723.98 ㎍으로 가장 높았으며, 그 다음 무 1022.89 ㎍, 고구마 487.76 ㎍, 배추 288.39 ㎍ 순이었다. 분석 결과, 네 종류 식물 잎 중 무의 우라늄 제거량이 2661.97 ㎍으로 구연산용액을 첨가하지 않은 토양에서 재배한 무의 우라늄 제거량(170.48 ㎍)보다 15배 이상으로 가장 많이 증가하였다(그림 7(a)). 식물 뿌리의 우라늄 제거량은 상추가 1723.98 ㎍으로 구연산용액을 첨가하지 않은 토양에서 재배한 상추 뿌리(404.48 ㎍)와 비교했을 때 4배 이상으로, 네 종류 식물 뿌리 중 가장 많이 증가하였다(그림 7(b)). 구연산용액을 첨가한 식물추출법의 경우, 식물 전체의 우라늄 절대제거량은 무가 3576.86 ㎍로 가장 높았으며 그 다음 상추 3017.22 ㎍, 고구마 2234.5 1㎍, 배추 608.92 ㎍ 순이었다. 무의 경우 우라늄 농도는 잎보다 뿌리가 높지만 잎의 생체량이 많기 때문에 식물 전체에 의한 총 우라늄 제거량은 뿌리보다 잎이 더 높게 나타났다. 식물 종류별 제거량 순서가 식물 종류별 우라늄 농도 순서와 다른 이유는 식물 종류별 성장속도가 달라, 각 포트 내 성장한 식물 생체량의 차이 때문에 제거량의 순서가 다르게 나타나기 때문으로 판단된다.
4. 토 의
토양 내 중금속의 존재형태를 연속추출법에 의해 5단계로 분류할 때, 식물이 이용 가능한 중금속은 토양 내 존재형태가 1단계인 교환성형태와 2단계의 탄산염결합형태인 중금속이라고 알려져 있다. 일반적으로 식물 내 우라늄 축적량을 결정하는 중요한 요소는 토양 내 우라늄 함량이지만, Alloway et al. (1988)은 토양의 중금속 함량이 높은 지역에서 자란 식물의 중금속 축적량이 오히려 낮게 나타날 수 있는 이유는 토양 내 금속들이 환원성 철/망간산화물형태와 산화성 유기물/황화물형태로 존재할 경우 식물이 금속을 흡수하기 어렵기 때문이라고 주장하였다. Zhang et al. (2006)은 카드뮴, 구리, 납으로 오염된 토양으로부터 차로의 전이량 측정 실험을 실시한 결과, 식물 조직 내로 전이된 중금속의 농도 대부분이 1단계인 교환성형태에서 기인한 것이며, 따라서 1단계 중금속량이 식물 전이량을 예측하는 지시자로 사용될 수 있음을 언급한 바 있다. Li et al. (2007)은 벼를 이용한 실험을 통해서 1단계와 2단계 존재형태의 중금속이 생물학적으로 전이가 가능한 것으로 보고하였고, Zheljazkov et al. (2008)은 제련소의 카드뮴 오염 토양을 대상으로 다섯 가지 약용식물을 재배하여 토양 내 중금속의 농도와 식물로 전이된 중금속 농도를 연속추출법 결과와 비교하여 식물 조직 내에 축적된 대부분의 중금속이 토양 내 중금속의 1단계인 교환성형태와 2단계인 탄산염결합형태에 해당됨을 확인하였다. Hong et al. (2009)도 옥수수를 이용한 실험을 통하여 다른 연구자들과 동일한 결과를 얻었으며, 옥수수를 이용해 CCA (chromated copper arsenate)로 오염된 토양에서 전이량을 예측하는 연구를 수행한 결과, 1단계인 교환성형태와 2단계인 탄산염결합형태에 해당되는 중금속이 생물학적 이용성을 가지며, 환원성 철/망간산화물형태인 3단계, 산화성 유기물/황화물형태인 4단계, 광물격자 내 잔류상형태인 5단계로 존재하는 중금속은 식물로의 전이가 거의 되지 않는다고 주장하였다. Alloway et al. (1988)은 토양의 pH가 비교적 높고(7.5~7.8), 토양 내의 금속들이 철/망간 산화물형태와 유기물과 결합되어 있으면 토양으로부터 식물이 금속을 흡수하기 어렵다고 보고하였다. 따라서 토양 내 중금속의 존재형태를 연속추출법에서의 5단계로 분류할 때, 토양 내에서 1단계인 교환성형태와 2단계인 탄산염결합형태로 존재하는 중금속이 식물이 이용 가능한 형태라고 받아들여지고 있다(Li et al., 2007).
위에서 언급한 이전 연구자들의 연구 결과에 근거하여 본 연구에서는 두 종류의 토양 내 우라늄의 존재형태의 특성을 파악하여 생물학적 이용 가능성이 있는 우라늄량(식물체로의 전이량)을 분석하였다. 우라늄 농도가 높은 덕평토양에 대하여 생물학적 이용 가능성이 높은 1단계와 2단계에 해당되는 우라늄량을 토양으로부터 식물로의 전이가 가능한 총 우라늄량(100%)으로 가정하여 네 종류 식물에 의한 식물추출법의 제거효율을 계산하였으며, 구연산용액을 첨가하지 않은 식물추출법과 첨가한 식물추출법 결과를 그림 8에 나타내었다. 덕평토양의 경우 생물학적 이용 가능성이 높은 1단계인 교환성형태와 2단계인 탄산염결합형태의 우라늄 함량 비율이 13%(2978.28 ㎍/kg)이었으며, 식물추출법으로 49일 동안 재배 후 식물의 총 우라늄 농도는 상추가 407.93 ㎍/kg, 배추 336.58 ㎍/kg, 고구마 317.86 ㎍/kg, 무 210.80 ㎍/kg이었다. 측정된 식물의 우라늄 농도로부터 오염토양 1 kg으로 건조중량 1 kg의 식물이 제거할 수 있는 우라늄량을 토양과 식물체 사이의 질량분배율로부터 계산하여 식물추출법에 의한 우라늄 제거효율을 계산한 결과, 상추 1kg을 이용한 식물추출법으로 덕평토양 1 kg 내 1-2단계 형태로 존재하는 우라늄을 13.70%, 배추는 11.30%, 고구마는 10.67%, 무는 7.08%제거할 수 있는 것으로 나타나, 토양 내 존재하는 1-2단계 형태의 우라늄 함량이 비교적 높은 덕평토양의 경우, 식물추출법 적용 시 식물의 우라늄 흡수율을 더 높일 수 있는 첨가제를 적용하는 것이 바람직 할 것으로 판단되었다.
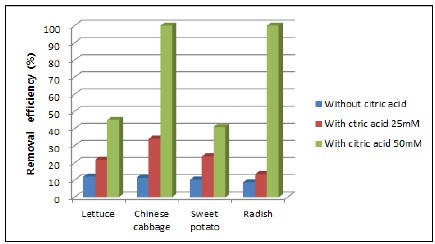
Removal efficiency of plants based on the uranium amount in step 1 and step 2 of the sequential extraction procedure for the Duckpyeong soil during the phytoextraction with/without citric acid solution.
덕평토양으로부터 우라늄의 식물 흡수율을 높이기 위하여, 킬레이트제로 구연산용액을 주입하여 실험한 결과, 구연산 25 mM 용액을 첨가한 경우 식물의 우라늄 농도는 상추의 경우 649.09 ㎍/kg, 배추는 1016.91 ㎍/kg, 고구마는 708.94 ㎍/kg, 무는 399.06 ㎍/kg으로 측정되어, 1-2단계 존재형태의 우라늄을 상추, 배추, 고구마, 무를 이용한 1회의 식물추출법으로 각각 21.79%, 34.14%, 23.80%, 13.40% 제거할 수 있는 것으로 나타났다. 구연산 50 mM 용액을 첨가한 경우 식물의 우라늄 제거능은 더 증가하여 1-2단계 존재형태의 우라늄을 상추는 44.94%, 배추는 100%, 고구마는 40.91%, 무는 100%를 제거하였다(그림 8). 이러한 결과는 구연산 50 mM 용액 첨가에 의해 배추와 무의 경우 1회 식물추출법을 적용하여 1 kg 덕평토양으로부터 토양 내 1-2단계로 존재하는 우라늄량을 거의 제거할 수 있다는 것을 의미한다.
5. 결 론
본 연구를 통하여 아래와 같은 결론을 도출할 수 있었다.
1) 국내 우라늄 오염 토양을 대상으로 한 식물추출법 실험 결과, 우라늄은 대부분 식물의 뿌리에 흡착되었고 잎으로의 전이율은 매우 낮았다. 식물추출법에 의해 토양으로부터 제거된 우라늄량은 토양 내에 식물전이가 가능한 우라늄량(주로 교환성/탄산염형태로 존재하는 우라늄량)에 비례하는 것으로 나타났다.
2) 구연산 50 mM 용액을 토양에 주입했을 때 식물 잎의 우라늄 농도는 구연산용액을 첨가하지 않은 토양에서 재배한 식물과 비교했을 때 식물 종류에 따라 최소 10배에서 최대 50배 이상 높았고, 식물뿌리의 우라늄 농도 역시 식물 종류에 따라 최소 3배에서 최대 10배 이상 높았다.
3) 덕평토양 1 kg에 대하여 구연산용액을 첨가하지 않은 식물추출법의 경우, 토양 내 1-2단계로 존재하는 우라늄의 14%만 제거되었으나, 구연산 50 mM 용액을 주입했을 경우 토양 내 1-2단계로 존재하는 우라늄을 배추와 무를 이용한 1회의 식물추출법으로 100% 제거할 수 있었다. 이러한 결과는 식물을 재배하는 토양에 구연산용액을 첨가하면 토양에 존재하는 우라늄의 용해도와 식물활성도를 증가시켜 우라늄을 쉽게 흡착되고, 빠르게 전이하기 때문이며, 특히 산성조건에서 ‘우라닐’ 양이온으로 존재하는 우라늄이 구연산과 반응하여 금속킬레이트 복합체를 형성하기 때문에 토양 내 1-2단계 형태로 존재하는 대부분의 우라늄을 식물체가 효과적으로 제거할 수 있는 것으로 판단된다.
Acknowledgments
이 논문은 부경대학교 자율창의학술연구비(2013년)에 의하여 연구되었음. 본 논문을 세심하게 심사하여주신 심사자들께 진심으로 감사드립니다.
References
-
B.J Alloway, I Thornton, G.A Smart, J.C Sherlock, M.J Quinn, Metal Availability. Special issue: the Shipham report : an investigation into cadmium contamination and its implications for human health, Science of The Total Environment, (1988), 75, p41-69.
[https://doi.org/10.1016/0048-9697(88)90159-3]

- J Antonkiewicz, C Jasiewicz, The use of plants accumulating heavy metals for detoxification of chemically polluted soils, Journal of Polish Agricultural Universities, (2002), 5, p121-143.
- F.A Bennett, E.K Tyler, R.R Brooks, P.E.H Gregg, R.B Stewart, Fertilization of hyperaccumulators to enhance their potential for phytoremediation and phytomining, Plants that Hyperaccumulate Heavy Metals, Cambridge, CABI Publishin, (1998), p249-259, (Brooks, RR. ed).
- R.R Brooks, General introduction. , In: Brooks, R.R., (Ed.), Plants that Hyperaccumulate Heavy Metals, CAB International, Wallingford, (1998), p1-14.
-
P Chang, K.W Kim, S Yoshida, S.Y Kim, Uranium accumulation of crop plants enhanced by citric acid, Environmental Geochemistry and Health, (2005), 27, p529-538.
[https://doi.org/10.1007/s10653-005-8013-5]

- C.M Chon, H.S Moon, S.K Choi, N.C Woo, A study on soil clay minerals and the distribution of heavy metals in soils derived from black shale and black slate in Dukpyoung area, Economic and Environmental Geology, (1997), 30(6), p567-586, (in Korean with English abstract).
-
O.P Dhankher, Y Li, B.P Rosen, J Shi, D Salt, J Senecoff, N Sashti, R.B Meagher, Engineering tolerance and hyperaccumulation of arsenic in plants by combining arsenate reductase and ga mma-glutamylcysteine synthetase expression, Nature Biotechnology, (2002), 20, p1140-1145.
[https://doi.org/10.1038/nbt747]

- L Duquène, H Vandenhove, F Tack, E Meers, J Baeten, J Wannijn, Enhanced phytoextraction of uranium and selected heavy metals by Indian mustard and ryegrass using biodegradable soil amendments, Science of The Total Environment, (2009), 407, p1496-1505.
-
E.G Gatliff, Vegetative remediation process offers advantages over traditional pump-and-treat technologies, Remediation, Summer, (1994), p343-352.
[https://doi.org/10.1002/rem.3440040307]

- M Ghosh, S.P Singh, A review on phytoremediation of heavy metals and utilization of its byproducts, Apply, Ecology Environmental Research, (2005), 3, p1-18.
- I Grenthe, J Fuger, R.J Lemire, A.B Muller, C Nguyen-Trung, H Wanner, I Forest, Chemical Thermodynamics of Uranium, Elsevier, (1992).
- Y.K Han, Application of phytoremediation for uranium contaminated soils and groundwater, Dp. Thesis, Pukyong National University, Korea (in Korean with English abstract), (2014).
-
C.O Hong, J Gutierrez, S.W Yun, Y.B Lee, C Yu, Heavy Metal Contamination of Arable Soil and Corn Plant in the Vicinity of a Zinc Smelting Factory and Stabilization by Liming, Archives of Environmental Contamination and Toxicology, (2009), 56, p190-200.
[https://doi.org/10.1007/s00244-008-9195-5]

-
J.W Huang, M.J Blaylock, Y Kapulnik, B.D Ensley, Phytoremediation of uranium-contaminated soils: Role of organic acids in triggering uranium hyperaccumulation in plants, Environmental Science & Technology, (1998), 32, p2004-2008.
[https://doi.org/10.1021/es971027u]

-
J.W Huang, S.D Cunningham, Lead phytoextraction: Species variation in lead uptake and translocation, New Phytology, (1996), 134, p75-84.
[https://doi.org/10.1111/j.1469-8137.1996.tb01147.x]

- J.C Igwe, A.A Abia, A bioseparation process for removing heavy metals from wastewater using biosorbents, African Journal of Biotechnology, (2006), 5, p1167-1179.
- M.C Jung, Sequential extraction of heavy metals in soils and A case study, Economic and Environmental Geology, (1994), 27(5), p469-477, (in Korean with English abstract).
-
I.A Katsoyiannis, H.W Althoff, H Bartel, M Jekel, The effect of groundwater composition on uranium(VI) sorption onto bacteriogenic iron oxides, Water Research, (2006), 40, p3646-3652.
[https://doi.org/10.1016/j.watres.2006.06.032]

- J.S Kim, H.T Chon, Dispersion and enrichment of potentially toxic elements in Chubu area covered with black shales and slates in Korea, Economic and Environmental Geology, (1997), 30(2), p89-103, (in Korean with English abstract).
-
N.D Kim, J.E Fergusson, Effectiveness of a commonly used sequential extraction technique in determining the speciation of cadmium in soils, Science of The Total Environment, (1991), 105, p191-209.
[https://doi.org/10.1016/0048-9697(91)90341-B]

- O.J Kim, K.D Min, K.H Kim, Geology and mineral resources of the Okchon zone-The boundary between the Okchon and Choson systems in the south of Iechon, and the geology in its vicinity-, Journal of Korean Institute of Mining Geology, (1986), 19(3), p225-230, (in Korean with English abstract).
- Korea Hydro & Nuclear Power Co (KHNP), Current Status of Radioactive Waste Management in Korea. Technical Report (http://www.khnp.co.kr/), (2013).
-
N.P.B.A Kumar, Phytoextraction: The use of plants to remove heavy metals from soil, Environmental Science & Technology, (1995), 29, p1232-1238.
[https://doi.org/10.1021/es00005a014]

- T Kumino, K Seaki, K Nagaoka, H Oyaizu, S Matusumoto, Characterization of copper-resistant bacterial community in rhizosphere of highly copper-contaminated soil, European Journal of Soil Biology, (2001), 37, p95-102.
- D Langmuir, Aqueous Environmental Geochemistry. Prentice-Hall, Inc, Upper Saddle River, NJ, (1997).
- C.H Lee, J.H Kim, Explanatory Text of the Geological Map of Goe San Sheet (1:50,000), Geological Survey of Korea, (1972).
- J.S Lee, H.T Chon, K.W Kim, Dispersion and enrichment of potentially toxic elements in the Chungjoo area covered with black shales in korea, Economic and Environmental Geology, (1996), 29(4), p495-508, (in Korean with English abstract).
- M.S Lee, H.T Chon, Geochemical correlations between uranium and other components in U-bearing formation of Okchon belt, Journal of Korean Institute of Mining Geology, (1980), 13(4), p241-246, (in Korean with English abstract).
- S.M Lee, H.S Kim, K.C Na, Explanatory Text of the Geological Map of Daejeon Sheet (1:50,000), Korea Research Institute of Geoscience and Mineral Resources, (1980).
-
J.X Li, X.E Yang, Z.L He, G Jilani, C.Y Sun, S.M Chen, Fractionation of lead in paddy soils and its bioavailability to rice plants, Geoderma, (2007), 141, p174-180.
[https://doi.org/10.1016/j.geoderma.2007.05.006]

-
J.C Lozano, P.B Rodriguez, F.V Tome, C.P Calvo, Enhancing uranium solubilization in soils by citrate, EDTA, and EDDS chelating amendments, Journal of Hazardous Materials, (2011), 198, p224-231.
[https://doi.org/10.1016/j.jhazmat.2011.10.026]

-
T Macek, M Mackova, J Kas, Exploitation of plants for the removal of organics in environmental remediation, Biotechnology advances, (2000), 18, p23-34.
[https://doi.org/10.1016/S0734-9750(99)00034-8]

-
J Mihalik, P Henner, S Frelon, V Camilleri, L Fevrier, Citrate assisted phytoextraction of uranium by sunflowers: Study of fluxes in soils and plants and resulting intra-planta distribution of Fe and U, Environmental and Experimental Botany, (2012), 77, p249-258.
[https://doi.org/10.1016/j.envexpbot.2011.11.024]

- H.S Moon, Clay Mineralogy, Minumsa, (1996), p380..
-
R.T Pabalan, D.R Turner, Uranium (6+) sorption on montmorillonite: experimental and surface complexation modeling study, Aquatic Geochemistry, (1997), 2, p203-226.
[https://doi.org/10.1007/BF00119855]

- R.D Reeves, A.J.M Baker, Metal-accumulating plants. In: Raskin, I. (Ed.), Phytoremediation of Toxic Metals: Using Plants to Clean Up the Environment, John Wiley & Sons, Incorporated, (2000), p193-229.
- J.H Saling, A.W Fentiman, Radioactive waste management, Taylor and Francis, 2nd ed., NY, 352, (2001).
-
D.E Salt, R.D Smith, I Raskin, Phytoremediation, Annual Review of Plant Physiology and Plant Molecular Biology, (1998), 49, p643-668.
[https://doi.org/10.1146/annurev.arplant.49.1.643]

- U Schmidt, Enhancing phytoextraction: the effect of chemical soil manipulation on mobility, plant accumulation, and leaching of heavy metals, Journal of Environmental Quality, (2003), 32, p1939-1954.
- J.L Schnoor, Phytoremediation, Ground-Water Remediation Technology Analysis Center, Pittsburgh, PA, (1998).
-
J.L Schnoor, L.A Light, S.C McCutcheon, N.L Wolfe, L.H Carreira, Phytoremediation of organic and nutrient contaminants, Environmental Science & Technology, (1995), 29(7), p318-323.
[https://doi.org/10.1021/es00007a002]

- D.B Shin, S.J Kim, Geochemical characteristics of black slate and coaly slate from the uranium deposit in Deokpyeong area, Economic and Environmental Geology, (2011), 44(5), p373-386, (in Korean with English abstract.
-
S.L Simonich, R.A Hites, Organic pollutant accumulation in vegetation, Environmental Science & Technology, (1995), 29(12), p2905-2914.
[https://doi.org/10.1021/es00012a004]

- M.P Souza, C.P Huang, N Chee, N Terry, Rhizosphere bacteria enhance the accumulation of selenium and mercury in wetland plants, Planta, (1999), 209, p259-263.
-
A Tessier, P Campbell, M Bisson, Sequential extraction proccedure for the speciation of particulate trace metals, Analysis Chemistry, (1979), 51, p844-851.
[https://doi.org/10.1021/ac50043a017]

- US EPA, Phytoremediation resource guide. EPA 542-B-99-003, (1999a).
-
T.D Waite, J.A Davis, T.E Payne, G.A Waychunas, N Xu, Uranium (VI) adsorption to ferrihydrite: application of a surface complexation model, Geochimica et Cosmochimica Acta, (1994), 58, p5465-5478.
[https://doi.org/10.1016/0016-7037(94)90243-7]

-
M Zhang, C Zhou, C Huang, Relationship Between Extractable Metals in Acid Soils and Metals Taken Up by Tea Plants, Communication in Soil Science and Plant Analysis, (2006), 37, p347-361.
[https://doi.org/10.1080/00103620500440095]

-
V.D Zheljazkov, E.A Jeliazkova, N Kovacheva, A Dzhurmanski, Metal uptake by medicinal plant species grown in soils contaminated by a smelter, Environmental Experimental Botany, (2008), 64, p207-216.
[https://doi.org/10.1016/j.envexpbot.2008.07.003]