해양환경에 따른 부유성 유공충 용해 정도 지표의 적용 가능성 평가
초록
부유성 유공충의 미화석은 과거 표층해양환경의 지시자로서 유용하게 이용된다. 이들은 퇴적된 후 종에 따라 다른 용해 저항성을 가지므로, 이에 따른 환경 기록의 왜곡 정도를 파악하기 위해 다양한 용해도를 평가할 수 있는 지표가 이용되어 왔다. 본 연구에서는 서로 다른 해양환경에서 획득된 네 점의 심해퇴적물 주상시료에서 분석한 여섯 가지의 용해도 평가 지표를 비교하여 평가하였다. 높은 정확도를 가지지만 많은 시간과 노력을 요하는 파편도(FLS)와 비교할 때, 각각의 지표는 환경 요소에 따라 다른 적용가능성을 나타냈다. 탄산염 함량(CaCO3)과 조립도(CSF)는 유공충이 우점하며 이외의 퇴적물 유입이 미미한 열대 해양에서 FLS와 좋은 상관관계를 보인다. 종 용해지표(FDX)와 저항종 비율(Res)은 용해 저항성이 강한 종의 상대적 비율에 기반한 지표로 일차적인 종 군집구조의 변화가 크지 않은 중앙 적도태평양 해역에서 적용하기에 적합하다. 저서성/부유성 비율(B)은 생산성이 높은 북서태평양 지역에서 FLS와 유사한 변화 양상을 나타내나, 먹이 의존도가 높은 저서성 유공충의 특성을 고려해야 한다. 본 연구의 결과를 통해 다양한 원양 퇴적환경에 대한 유공충 용해 지표의 적용 기준을 제시하였다.
Abstract
Fossil planktic foraminifera is a useful indicator of the paleoenvironment of the surface ocean. Because of its susceptibility to dissolution, various indices for preservation state of planktic foraminifera have been used to determine better the degree of bias introduced by the species-dependent resistance to dissolution. This study aims to evaluate six dissolution indices of foraminifera from four Pacific sites, each representing different surface and deep ocean condition. Compared to the fragmentation rate (FLS), demanding and time-consuming but one of the most reliable dissolution indices regardless of the ambient environment, each index has different sensitivity on preservation state owing to the environmental factors. Carbonate fraction (CaCO3) and coarse sized fraction (CSF) are fairly well correlated with FLS in the foraminifera-dominated tropical ocean where the influx of other sedimentary components is insignificant. The assemblage dissolution index (FDX) and percentage of resistant species (Res) based on the relative enrichment of dissolution-resistant species are best applicable at the central equatorial Pacific site without any significant changes in the primary faunal assemblage. The benthic/planktic ratio (B) varies with FLS similarly at a productive Northwestern Pacific site, but should be carefully applied in many cases owing to the strong dependence of benthic foraminifera on food availability. The results of this study suggest the importance of rigorous application criteria of the foraminifera dissolution index in various depositional environments.
Keywords:
planktic foraminifera, carbonate, dissolution index, Pacific Ocean키워드:
부유성 유공충, 탄산염, 용해지표, 태평양1. 서 론
심해퇴적물 내 미화석의 종 조성을 이용한 고환경 해석은 해당 생물 군집이 퇴적될 당시의 해양환경이 현생 군집의 서식환경과 동일함을 전제로 한다. 그러나 미화석은 퇴적과정과 속성작용을 거치는 동안 다양한 환경 요인(예, 온도, 압력, pH 등)에 의해 변질되어 왜곡된 군집조성을 나타낼 가능성이 있다. 특히 탄산염(CaCO3)으로 이루어진 유공충의 각(test)은 수심이 깊어지면서 낮은 온도와 높은 압력에 의해 부분적 용해가 발생하기 쉽다. 이에 따라 탄산염 보상심도(calcite compensation depth)나 탄산염 용해약층(calcite lysocline) 이하 수심의 퇴적물에는 유공충 각이 매우 손상되거나 산출되지 않는다(Berger, 1971). 이러한 용해작용은 수층 뿐 아니라 공극수의 탄산염 포화도에도 영향을 받기 때문에 유공충 각의 용해는 매몰 후에도 지속된다(e.g., Emerson and Bender, 1981; Archer and Maier-Reimer, 1994; Naik and Naidu, 2010).
부유성 유공충은 각각의 종들의 각의 크기, 밀도 또는 형태 등에 의해 차별적인 용해 저항성을 나타낸다(Parker and Berger, 1971; Berger and Piper, 1972). 예를 들어, 크기가 작고 밀도가 낮은 각을 가진 유공충 종들(예: Globigerinoides ruber 또는 Globigerina rubescens)은 용해에 취약한 반면, 각의 크기가 크고 밀도가 높은 종들(예: Globorotalia tumida 또는 Pulleniatiana obliquiloculata)은 상대적으로 용해에 강하다(Parker and Berger, 1971). 유공충 각은 용해가 진행됨에 따라 쉽게 파편화되어 종 동정이 어렵거나 쉽게 분쇄되기 때문에(Kucera, 2007의 Figure 19 참조) 탄산염 포화도가 낮은 해저 환경에서는 용해에 강한 종들의 비율이 상대적으로 높게 산출된다(Pfuhl and Shackleton 2004). 이러한 차별적 용해의 결과로 퇴적물 내에서 관찰되는 유공충 종의 조성이 생존 당시의 군집 구조와 일치하지 않는 경우가 발생하며, 이에 따른 왜곡된 해석을 피하기 위해서는 미화석 군집에 대한 용해 정도를 평가하는 작업이 필요하다.
부유성 유공충의 용해 정도를 평가하는 방법 중 중간 정도의 용해저항성을 가지는 Globorotalia menardii 각의 파편도(MFI; G. menardii fragmentation rate) 측정법(Mekik et al., 2002)과 Globigerina bulloides의 각밀도를 X-ray CT를 이용해 측정하는 방법이 높은 신뢰도를 갖는다(Iwasaki et al., 2015). 그러나 해당 종이 분포하지 않거나 출현 빈도가 낮은 해역에서는 신뢰도가 낮고 분석에 많은 시간이 소요되는 단점이 있다. 이에 총 개체수에 대비하여 부서진 각의 개수에 기반한 파편도(Berger, 1970; Le and Shackleton, 1992; Greene et al., 1994; Conan et al., 2002)가 비교적 신뢰도 높은 지표로 이용되어 왔으나, 연구자의 편의에 따라 이외의 다양한 방법으로 용해 정도를 평가하였다(표 1). 그러나 많은 용해 지표들은 퇴적물의 구성 성분간의 상대적 비율을 이용하므로, 일차적인 구성 성분이 환경에 좌우되되어 지역 간 비교가 어렵고 때때로 파편도와 크게 차이가 나는 경우가 발생한다(e.g., Li and Jian, 2001; Hancock and Dickens, 2006).
부유성 유공충의 과거 군집 구조를 해석하는 데 있어 용해의 영향을 판단하는 절차는 필수적으로 선행되어야 하며, 이를 위해 연구 해역 내 각각의 환경인자의 민감도를 이해하고 해당 해역에 가장 적합한 용해 지표를 선정해야 할 것이다. 이러한 중요성에도 불구하고 지금까지 해양 환경 특성에 따른 용해 지표간 특성 변화를 직접 비교한 연구가 거의 수행되지 않았다. 따라서 본 연구에서는 북서태평양 쿠로시오 확장역, 서태평양 난수역, 동태평양 용승역 등 서로 다른 해양환경에서 각각 획득한 네 점의 퇴적물 코어를 이용하여 다양한 용해 지표를 산출하고 이들과 환경 인자와의 관련성을 밝혀 각 해역에 적합한 용해 지표를 제시하고자 한다.
2. 연구 지역 및 시료
본 연구에서는 해양환경이 서로 다른 태평양의 네 지역에서 획득한 심해퇴적물 코어로부터 용해 지표의 적합성을 평가하였다(그림 1; 표 2). 모든 시료는 2005년부터 2013년까지 한국해양과학기술원의 온누리호를 이용하여 수행된 태평양 해저광물자원 개발사업 실해역 탐사 혹은 이동 항해 중 획득되었다. MC 090301(6°40’N, 177°28’W, 3409 m depth)이 채취된 중앙태평양 적도 해역의 마젤란 해저고원은 서태평양 난수대의 동쪽 경계부에 위치한다. 일반적으로 난수역대는 표층 수온이 높고 염도가 낮아 수층의 안정도가 높아 유공충 및 석회미세조류가 우점하여 퇴적물 내 탄산염함량이 높고(88-90%) 생물 기원 오팔의 함량은 1-12%이다(Reimers and Wakefield, 1989; Kawahata et al., 2000). 한편 북서태평양 쿠로시오 확장역은 아열대와 아한대 환류의 경계부에 위치하며 해양환경의 변동성이 크며, 이러한 특성은 과거 퇴적기록에도 나타난다(e.g., Bordiga et al., 2014; Seo et al., 2018). 이 해역에서 획득한 NPGP 1302-1B 코어(32°18’N, 158°14’E, 2503 m depth)는 대륙기원 퇴적물의 함량 약 20-40%, 탄산염 함량 약 50-70%, 생물기원 오팔 함량 약 3-5%로 보고되었다(Yamane, 2003). 동태평양 적도 해역은 북적도해류(North Equatorial Current), 북적도반류(North Equatorial Countercurrent), 남적도해류(South Equatorial Current)가 교차하는 지역으로 위도에 따라 해양환경이 변화한다(Murray and Leinen, 1993). MC 5107 (1°59’N, 131°32’W, 4421 m depth) 코어가 채취된 북위 2° 인근에서는 탄산염이 70%, 생물기원 오팔이 18%를 차지하며, MC 5111(6°00’N, 131°29’W. 4085 m depth) 코어가 채취된 북위 6° 해역에서는 탄산염이 61%, 생물기원 규소가 10%로 나타난다(Murray and Leinen 1993). MC 090301, MC 5107, MC 5111이 채취된 태평양 적도 해역의 탄산염보상심도(CCD; Carbonate Compensation Depth)는 약 5,000 m, NPGP 1302-1B가 채취된 북서태평양 쿠로시오 확장역 인근의 CCD는 약 4,200 m 깊이에 위치하여(Lisitzin, 1996; McCarthy et al., 2004) 연구 해역 모두에서 탄산염 퇴적물의 보존이 비교적 양호하다.
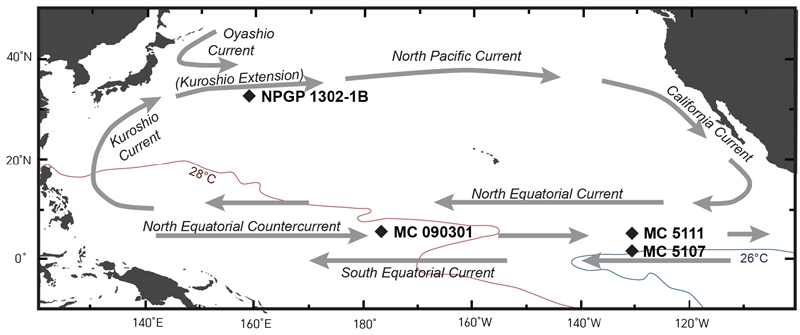
Core locations and major surface current system. Red and blue line represent 28℃ and 26℃ isotherm of sea surface temperature in World Ocean Atlas 2018 (Locarnini et al., 2018).
3. 연구 방법
각각의 코어 퇴적물에서 1 cm 간격으로 부시료를 채취한 후 24시간 이상 동결 건조하였다. 건조 퇴적물 0.5~1 g을 2% 헥사메타인산나트륨((NaPO3)6) 용액에 담그고 63 μm 체로 습식 체질 후 건조하여 중량을 측정하였다. 건조된 시료는 125 μm 체로 건식 체질 후, 부유성 유공충의 종조성 분석에 유효한 개체 수인 300개체 이상이 될 때까지 샘플 분할기(riffle sample divider)로 균일하게 나누었다. 분할한 퇴적물 중 부유성과 저서성 유공충, 유공충 파편의 개수는 실체 현미경 하에서 관찰하였다. 유공충은 완전한 각의 모양이 2/3 이상 남아 있는 개체를 완전한 각으로, 그 이하를 파편으로 분류하였다.
시료당 약 10 mg의 분말 퇴적물을 무기탄소분석기(UIC CO2 Coulometer, Model CM5104)를 이용해 분석한 총무기탄소(total inorganic carbon, TIC) 함량에 탄산염(CaCO3)과의 질량비(8.333)를 곱하여 탄산염 함량을 구하였다. 분석 오차는 약 ±0.4%이다.
시대에 따른 용해 지표의 변화양상의 지역간 비교를 위해 각각 시료의 퇴적 연대를 파악하였다. NPGP 1302-1B의 퇴적연대는 Seo et al. (2018)에, MC 090301의 퇴적연대는 Seo et al. (2016)에 기반하였다. NPGP 1302-1B 코어는 마지막 빙하기 이후에 퇴적된 상부 60 cm 구간을 연구 대상으로 하였다. MC 5107의 연대는 시료 내 포함된 부유성 유공충을 종 구분 없이 추출하여 미국의 Beta Analytic Radiocarbon Dating Laboratory에서 가속질량분석기(Accelerator Mass Spectrometer, AMS)를 이용하여 측정한 방사성탄소(14C) 연대를 이용하였다. 14C 연대는 Marine13 프로그램의 데이터베이스를 이용하여 역연대(歷年代, Calendar Age; cal yrs BP)로 환산하였다(Reimer et al., 2013). 해양 저장소 효과(Marine Reservoir Effect)에 의한 지역 보정값(ΔR=9±5 yr)은 MC 5107로부터 가장 가까운 10개 지역에서 보고된 지역보정값의 가중평균치를 계산하여 산출하였다(Broecker and Olson, 1961; Petchy et al., 2008; Burr et al., 2009; Zaunbrecher et al., 2010). MC 5111의 퇴적 연대는 유공충 Pulleniatina obliquiloculata의 안정산소동위원소(δ18O)비를 측정하여 MC 5107과의 층서적 비교를 통해 결정하였다.
4. 부유성 유공충 용해 정도 평가 지표
현재까지 제시된 용해도 평가지표는 표 1에 요약하였다. 초기 연구들에서는 부유성 유공충의 용해 정도를 주로 탄산염 함량 (“CaCO3”)이나 사질(>63 μm) 크기 입자의 무게비율(coarse-size fraction; “CSF”)을 이용하여 평가하였다(Olausson, 1965; Hays and Perruzza, 1972; Malmgren, 1983). 이 두 방법은 과정상 가장 간편한 방법으로, CaCO3는 퇴적물 내 탄산염 광물의 함량이 용해 정도를 반영한다고 판단하는 반면, CSF는 전체 퇴적물에 대한 63 μm 이상 퇴적물의 무게 비율을 측정하는 방법(e.g., Peterson and Prell, 1985)으로, 63 μm 이상에서는 온전한 부유성 유공충이, 63 μm 이하에서는 용해된 부유성 유공충 파편이 남아있다는 전제하에 용해 정도를 구하는 방법이다.
현재 부유성 유공충 용해 정도를 평가하는 가장 일반적인 방법은 완전한 각의 형태를 갖춘 유공충 개체 수에 대한 유공충 파편의 개수 비율로 용해 정도를 파악하는 파편도(“F”)이다(Berger 1970). 완전한 각은 전체의 2/3 이상이 남아있는 각을 의미하며, 파편도의 값이 높을수록 부유성 유공충 군집이 용해의 영향을 많이 받았음을 의미한다(e.g., Berger, 1970; Peterson and Prell, 1985). 파편도는 초기 함량이나 다른 성분의 함량에 영향을 받을 수 있는 CaCO3나 CSF와는 달리 유공충 각의 용해 정도를 직접 평가하는 방법으로, 여러 가지 용해 지표 중 용해의 정도를 파악하는 가장 정확한 방법으로 알려져 있다(Conan et al., 2002). 하나의 완전한 각에서 만들어지는 파편의 개수는 평균 8개로, 이를 보정한 “FLS”(Le and Shackleton, 1992)가 보다 발전된 형태의 파편도 지수로 이용되고 있다(Conan et al., 2002).
저서성 유공충 비율(“B”)은 저서성 유공충이 부유성 유공충보다 약 세 배 이상 용해에 강하다는 사실에 기초한다. 즉, 유공충 군집에서 저서성 유공충에 대한 부유성 유공충의 비율을 산출하여 용해 정도를 평가하는 방법이다(Arrhenius, 1952; Thunell, 1976). 또한, 방산충 비율(“R”)은 규질(SiO2) 성분의 방산충과 탄산염 성분의 유공충이 서로 다른 환경 조건에서 용해되는 사실을 토대로, 부유성 유공충과 방산충의 개체 수 합에 대한 방산충 개체 수의 비율로 나타낸다(Rottman, 1979; Peterson and Prell, 1985; Conan et al., 2002).
부유성 유공충 군집의 종 조성을 이용한 방법도 용해 정도의 평가에 널리 사용된다. 일반적으로 부유성 유공충은 종에 따라 그 각의 용해 저항성이 다르다. 따라서 동일한 환경에서 종에 따른 차별적 용해를 받고, 쉽게 깨지는 종과 그렇지 않은 종으로 구분할 수 있다(e.g., Schott, 1935; Ruddiman and Heezen, 1967). 즉, 탄산염의 용해가 활발한 환경(예, 수온이 낮거나, 압력이 높은)일수록 전체 유공충 군집에서 각이 쉽게 깨지는 종이 제거되어 군집조성에서 이들 종들의 비율은 감소하게 된다. 이처럼 전체 유공충 군집에서 용해에 강한 종의 비율(“Res”)로 용해 정도를 판단할 수 있다(Ruddiman and Heezen, 1967). 종마다 용해에 강한 정도를 상대적 순위를 정하여 산출된 비율과의 곱으로 용해 정도를 평가하는 방법(FDX)도 있다(Berger, 1968). 또한, 일반적으로 용해에 강한 종은 수온약층 이하 깊은 수심에 서식하며 대부분 가시가 없는 종(non-spinose species)임을 이용(e.g., Chaisson, 1995; Kucera, 2007)하여 전체 유공충 함량에서 “깊은 수심에 서식하는 종의 비율(Deep)”과 “가시가 없는 종의 비율(Non)”을 바탕으로 용해 정도를 평가할 수 있다. Res, Deep, Non의 경우 값이 높을수록 용해가 많이 일어났음을 지시한다(Berger, 1968; Chaisson, 1995). 이 외에도 유사한 환경에 서식하면서 용해 정도의 차이를 보이는 두 그룹의 비(SI1, SI2, SI3)를 이용하는 방법도 사용되고 있다(Volat et al., 1980). 본 연구는 유공충의 용해도 평가에 주로 사용되는 FLS, CaCO3, CSF, B, FDX, Res를 분석하고, 각 해역에서 이들 지표의 적합성에 대한 평가를 실시하였다.
5. 결과 및 토의
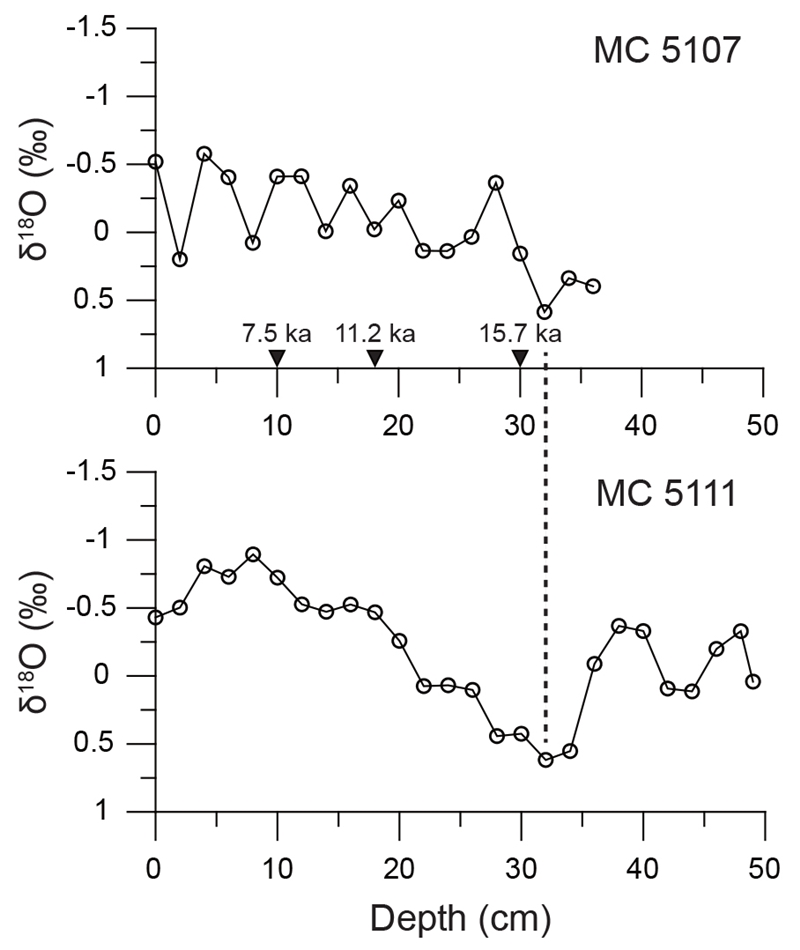
MC 5107의 방사성탄소 조성 및 역연대는 표 3에, 각각 코어의 지표값은 표 4에 제시하였다. MC 5107과 MC 5111의 δ18O 값은 그림 2에 도시하였다. 두 코어의 δ18O 값은 대체로 깊이에 따라 유사한 변화 양상을 보이며, 특히 δ18O의 최대값이 나타나는 깊이가 31 cm로 동일하다. 최대값 역시 MC 5107에서 0.59, MC 5111에서 0.62로 유사하여, 두 지역의 선형퇴적률의 차이가 미미하다고 가정하고 동일한 퇴적연대를 적용하였다.
용해 지표 중 FLS가 정확성이 가장 높은 방법으로 알려져 있기 때문에(Conan et al., 2002), 본 논문에서는 5가지 용해 지표들(CaCO3, CSF, B, FDX, Res)을 FLS와 비교하여 지표로서의 적합성을 판단하였다. FLS의 변화 양상은 지역에 따라 크게 다르지 않으며 대체로 빙하기로부터 마지막 해빙기(12-17 kyrs BP)에 이르며 증가하다 이후 감소하는 양상을 보이는 데 비해, 각각의 용해 지표는 연구 해역의 환경 특성에 따라 FLS와 유사하거나 상이한 결과를 나타냈다(그림 3, 4, 5, 6). 이에 따라 FLS와 각 지표간의 상관관계를 지역에 따라 표 5에 제시하였다. 각 지표가 용해도를 잘 반영한다 가정하면, CaCO3와 CSF는 값이 높을수록 용해의 영향이 작다고 볼 수 있으므로 FLS와 음의 상관계수를, B, FDX, Res는 양의 상관계수를 나타낼 것이라고 예상할 수 있다. 지표간 상관관계와 각 지표의 변화 경향으로 볼 때, 쿠로시오 확장역(NPGP 1302-1B)에서는 B가 FLS와 가장 잘 일치하며 CaCO3와 FDX, Res는 FLS와 반대의 경향을 보이는 반면 CSF는 전 구간에서 큰 변화를 보이지 않았다(그림 3). 중앙태평양 적도 해역(MC 090301)의 경우, CaCO3, CSF, FDX, Res는 FLS와 모두 약한 상관관계를 나타내지만(표 4), B는 퇴적물 상부에서 FLS와 반대의 양상을 보인다(그림 4). 동태평양 적도 해역(북위 2도)의 MC 5107에서는 CaCO3와 B가 FLS와 유사한 경향을 보이며 FDX와 Res는 대체로 좋은 상관관계를 나타내나 퇴적물 최하부에서 다소 상이하게 나타난다(그림 5a, 5b, 5d, 5e). CSF는 전 구간에 걸쳐 변화가 크지 않으며 FLS와 약한 상관관계를 보인다(그림 5c). MC 5111(북위 6도)에서는 CaCO3와 CSF가 FLS와 좋은 상관관계를 가지며(표 5, 그림 6a-c), B의 변화 양상은 FLS와 반대로 나타난다(그림 6d). FDX와 Res의 경우 15 ka 이전까지 FLS와 상이한 변화를 보이나 그 이후는 변화 경향이 일치한다(그림 6e).
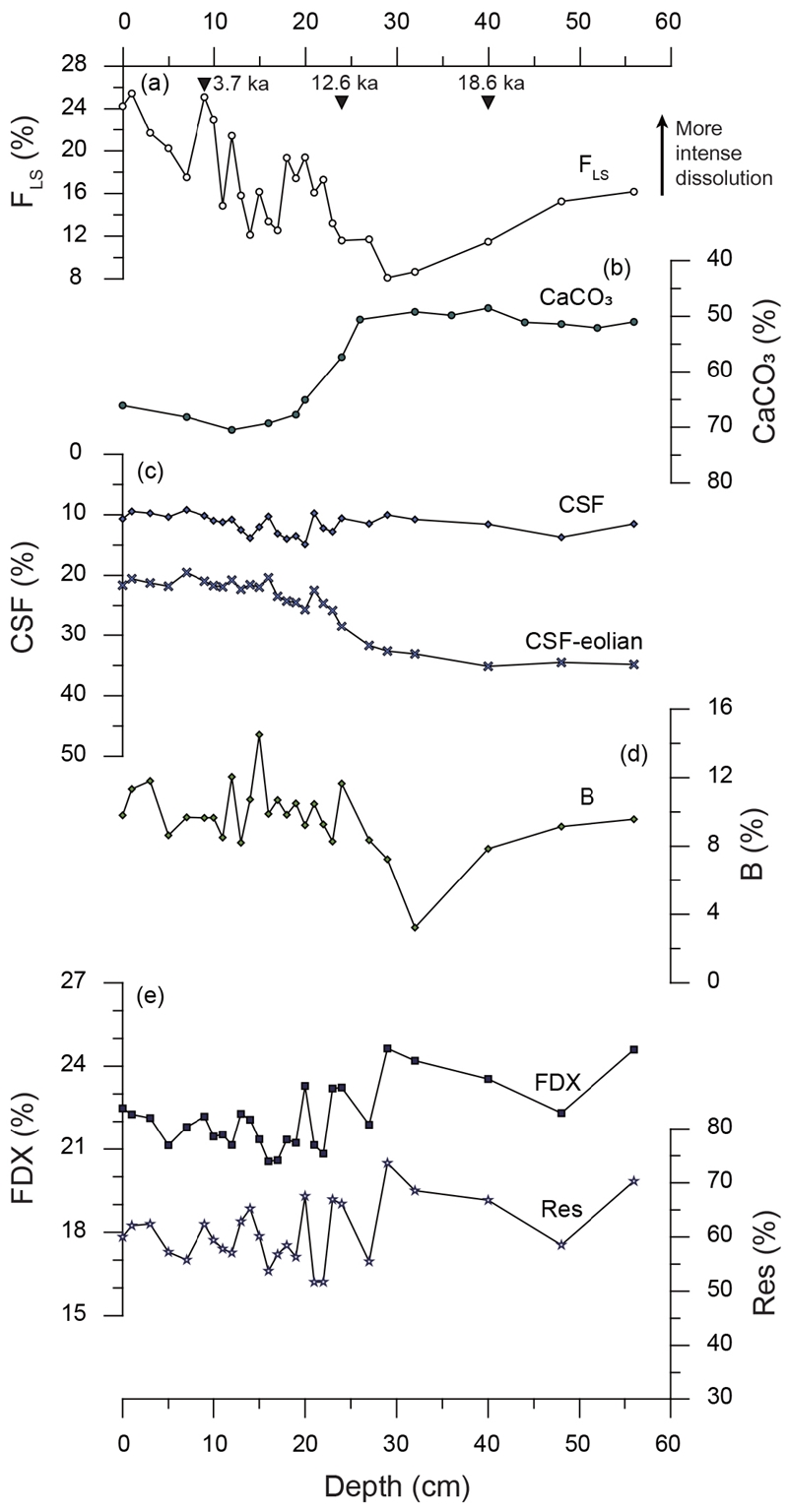
Comparisons of various foraminifera dissolution indices of NPGP1302-1B sediment with (a) FLS, (b) CaCO3, (c) CSF and CSF-Eolian, (d) B, and (e) FDX and Res. Black triangles in the graph (a) represent the determined depositional ages (Cal yrs BP). See Table 1 for abbreviations.
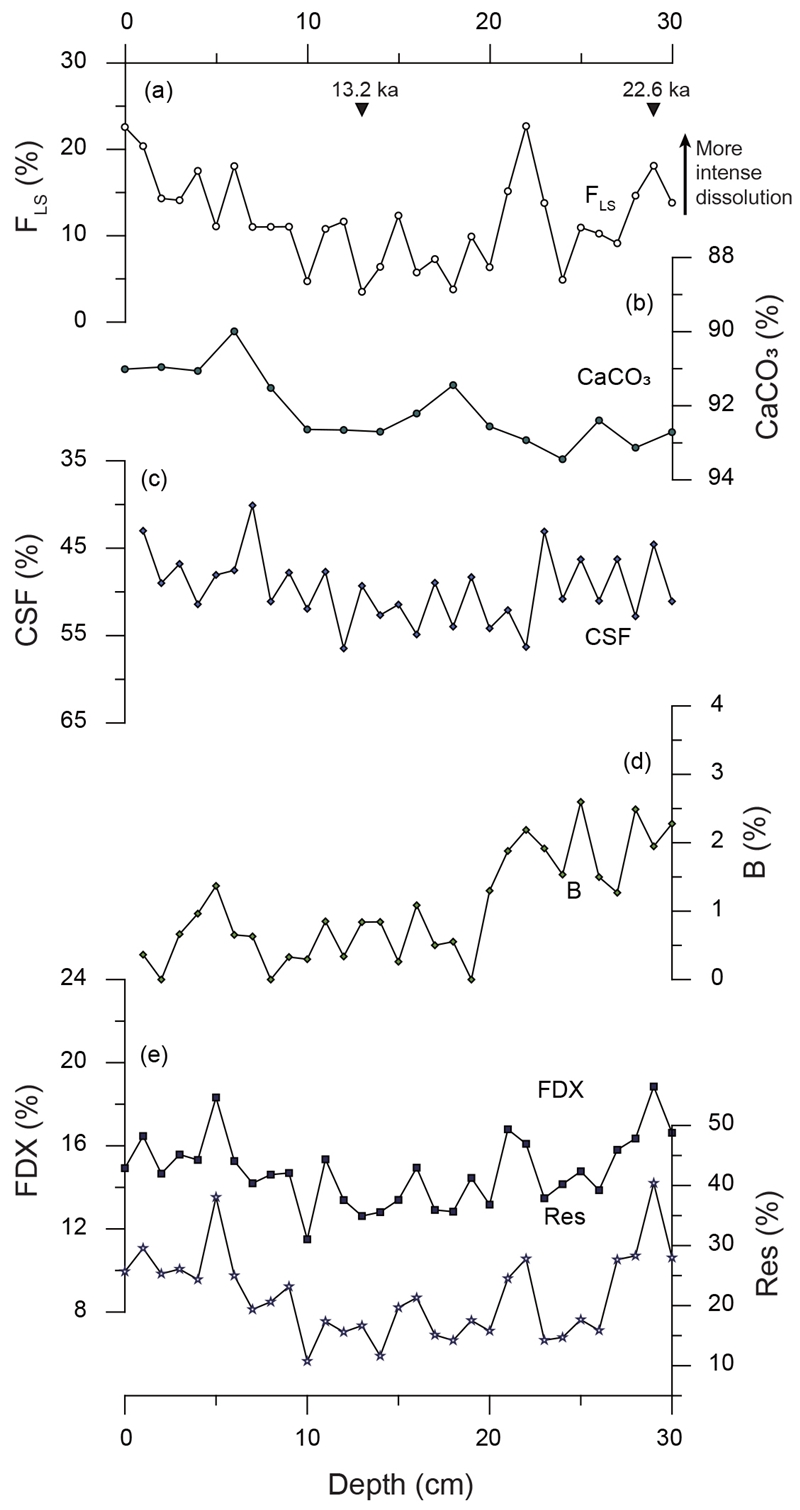
Comparisons of various foraminifera dissolution indices of MC 090301 sediment with (a) FLS. (b) CaCO3, (c) CSF, (d) B, and (e) FDX and Res. Black triangles in the graph (a) represent the determined depositional ages (Cal yrs BP).
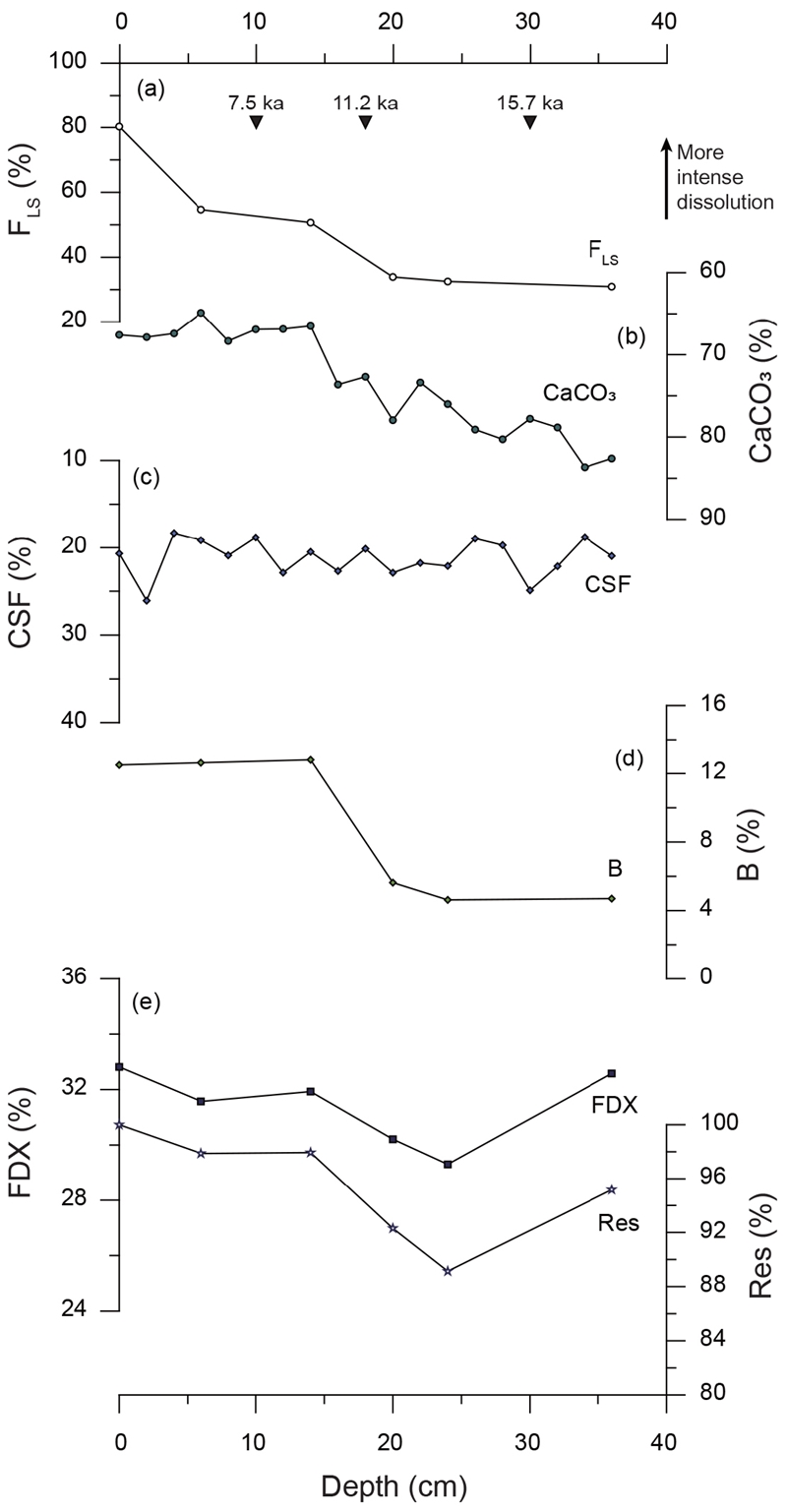
Comparisons of various foraminifera dissolution indices of MC 5107 sediment with (a) FLS. (b) CaCO3, (c) CSF, (d) B, and (e) FDX and Res. Black triangles in the graph (a) represent the determined depositional ages (Cal yrs BP).

Linear correlation coefficient between FLS and other five indices of foraminifera dissolution from studied cores.
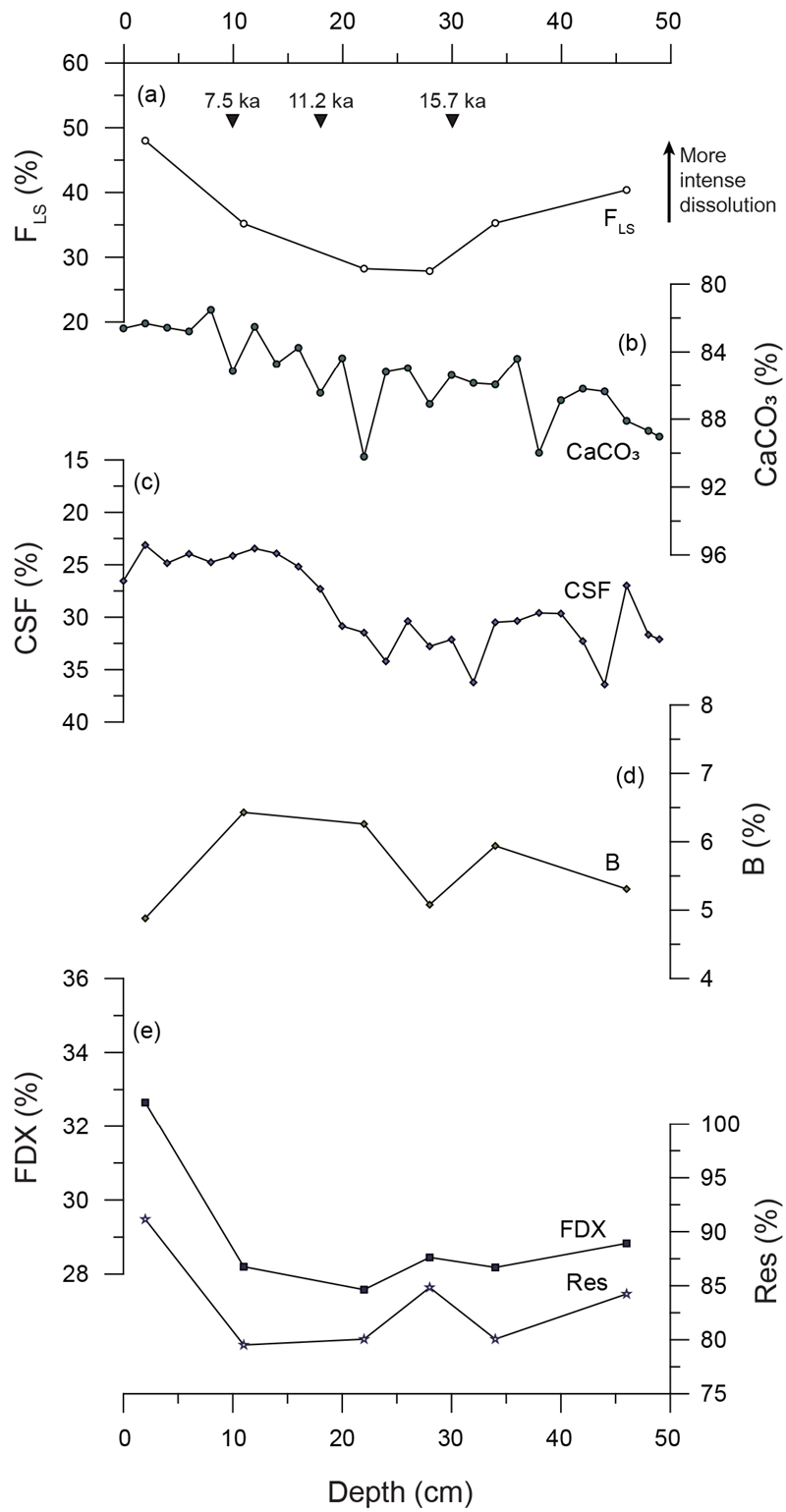
Comparisons of various foraminifera dissolution indices of MC 5111 sediment with (a) FLS. (b) CaCO3, (c) CSF, (d) B, and (e) FDX and Res. The black triangles in (a) represent the depositional ages based on the graphical correlation of δ18O profiles of P. obliquiloculata with MC 5107.
CaCO3(%)
일반적으로 해저 퇴적물의 탄산염 함량은 탄산염질 퇴적물의 공급량, 비탄산염질 퇴적물의 공급으로 인한 희석, 탄산염 광물의 용해 정도에 좌우되므로 각 해역에서의 CaCO3는 이러한 요소들의 변화를 반영하게 된다(Berger et al., 1976; Biscaye et al., 1976). MC 090301이 채취된 중앙태평양 적도 해역은 대륙기원 퇴적물의 유입이 적고 표층 생산성이 낮아 다른 생물기원 퇴적물의 함량이 낮기 때문에 유공충 연니가 주로 분포한다. 따라서 이 해역에서 유공충의 용해는 탄산염 함량을 감소시키는 직접적 요인이며 퇴적물 내 산출되는 CaCO3 변화는 결국 유공충의 용해 정도를 중요하게 반영한다 볼 수 있다. 이는 MC 090301 퇴적물에서 CaCO3 변화 폭이 미미함에도 불구하고 FLS와 대체로 일치하는 것으로 뒷받침된다(그림 4b).
동태평양 적도 해역(MC 5107, MC 5111)은 서태평양 해역에 비해 상대적으로 생산성이 높음에도 불구하고(e.g., Honjo et al., 1982; Khim et al., 2012), CaCO3변화가 FLS와 유사한 변화 양상을 보인다(그림 5b, 6b). 이는 해당 해역에서 해양환경 변화에 따른 탄산염 공급량 변화보다 용해에 의한 탄산염 함량 변화가 상대적으로 컸을 가능성을 시사한다. 실제로 두 해역은 다른 지역에 비해 높은 FLS 값(30-80%)을 보여, 부유성 유공충이 용해의 영향을 강하게 받았음을 짐작할 수 있다. FLS와 CaCO3와 유사한 변화 양상을 보이는 것 동태평양 적도 해역에서 유공충의 용해 정도가 CaCO3에 잘 반영되었음을 의미한다. 따라서 이번 연구 결과는 탄산염 함량 변화가 동태평양 적도 해역, 특히 용해가 심하게 발생하는 깊은 수심대에서 적절한 용해 지표로 사용될 수 있음을 지시한다.
한편, 쿠로시오 확장역에서 깊이에 따른 CaCO3 변화는 적도 해역과는 달리 FLS와 반대의 경향을 보인다 (그림 3b). 이러한 결과는 이 해역에 대륙 기원 퇴적물의 함량(10-30%; Bordiga et al., 2014)이 높은 것과 관련지을 수 있다. 이 해역에서 대륙 기원 퇴적물의 함량은 지난 빙하기 이후 현재까지 약 20% 정도 감소하며(Bordiga et al., 2014), 이는 탄산염 함량의 변화 폭과 매우 유사하다. 이러한 점은 이 해역 탄산염 함량 변화가 용해보다는 대륙 기원 퇴적물의 함량에 따른 희석 효과에 더 큰 영향을 받는 것을 지시한다. 결론적으로 CaCO3는 기후 변화에 따른 환경변화가 작거나, 공급되는 퇴적물 내 탄산염 함량, 특히 유공충의 비율이 높고, 용해가 강하게 발생하는 해역이나 수심대에 적합한 반면 환경변화가 크고 육성기원 퇴적물의 유입량 변화가 높은 해역에서는 적합하지 않은 것으로 판단된다.
CSF
중앙태평양 적도 해역(MC 090301)에서 CSF는 변화폭이 매우 작아 FLS와 낮은 상관계수를 가지나, 그래프상 그 변화 양상이 일치하는 양상을 보인다(그림 4c). 이러한 결과는 해당 해역에 유입되는 대륙 기원 입자와 다른 생물 기원 입자의 양이 매우 작고 유공충이 퇴적물의 주성분이기 때문으로 보인다(Reimers and Wakefiedl, 1989). 실제로 연구 시료 중 63 μm 크기 이상의 퇴적물은 대부분이 완전한 부유성 유공충으로 이루어져 있으며, 63 μm 이하의 퇴적물은 대부분 부유성 유공충의 파편이나 석회미세조류로 구성되어 있다. 따라서 중앙태평양 적도 해역은 CSF를 용해 지표로 사용할 수 있는 적합한 환경으로 판단되며, 이러한 해석은 유사한 해양환경을 가진 서태평양 난수역에서 CSF를 이용하여 용해 정도를 해석한 기존의 연구 결과(e.g., Kimoto et al., 2003)로도 잘 뒷받침된다.
쿠로시오 확장역의 CSF는 전 구간에서 매우 낮게 나타나고(약 10%) 깊이에 따라 큰 변화를 보이지 않는다(그림 3c). 이는 이 지역에 공급되는 세립질 퇴적물(주로 석회미세조류와 대륙 기원-주로 풍성-입자)의 비율이 다른 해역에 비해 매우 높기 때문으로 여겨진다. 63 μm 미만의 입자에서 대륙 기원 입자의 영향을 배제하기 위해 Bordiga et al. (2014)이 인근 해역(ODP Site 1209, 32°39’N, 158°30’E)에서 제시한 지질연대에 따른 대륙 기원 퇴적물의 양을 본 연구의 결과로부터 구한 63 μm 미만 성분에서 배제하였다. 이러한 방법으로 다시 계산한 CSF (CSF-Eolian)의 변화 양상은 보다 FLS와 유사하게 나타난다(그림 3c). 이러한 사실로부터, 이 해역에서 CSF는 세립질 대륙 기원 입자의 유입량이 더 중요하게 반영된다고 볼 수 있다. 또한 이 해역 퇴적물에는 세립(<20 μm; Chiu and Broecker, 2008)의 석회미세조류 파편이 다량 포함되어 있고 함량변화폭이 매우 크기 때문에(약 20%) CSF 변화 양상에 영향을 주었을 가능성이 높다. 풍성기원입자의 함량에 대해 보정한 CSF (CSF-Eolian) 값이 FLS와 일치하지 않은 일부 구간의 경우 석회미세조류의 함량 변화가 영향을 미쳤을 가능성이 있다.
동태평양 적도 해역에 위치한 두 시료(MC 5107, MC 5111)의 CSF는 서로 다른 양상을 보인다(그림 5c, 6c). 보다 저위도에 위치한(2°N) MC 5107은 전 구간 변화가 크지 않은 반면 북위 6°에서 채취한 MC 5111에서 CSF 값은 코어 상부로 갈수록 증가하는 FLS와 유사한 변화 양상을 보인다(그림 5c, 6c). 이러한 차이는 두 해역의 퇴적물 내 생물기원 오팔 함량(MC 5107: ca. 20%, MC 5111: ca. 10%)의 차이에서 기인한 것으로 판단된다(Honjo et al., 1982; Murray and Leinen, 1993). 동태평양 적도해역에서 생물기원 오팔은 대개 규조류에 의해 형성되어 그 크기가 63 μm 보다 작기 때문에, 이들의 함량 변화가 MC 5107의 CSF 값에 보다 큰 영향을 미친 것으로 해석할 수 있다.
이러한 결과로부터, CSF는 단지 특정 크기(63 μm 이하) 퇴적물의 무게비로부터 산출되므로 입도 분포에 영향을 미치는 다른 성분의 유입량이나 그 변화폭이 큰 지역에서 매우 취약한 사실이 드러난다. 즉, CSF 용해지표는 육성기원 퇴적물(63 μm 이하)이나 유공충 이외의 미화석(방산충, 규조류, 인편모조류 등)의 영향을 배제하지 않기 때문에 환경 조건에 따라 이들 함량이 크게 변화하는 지역에서는 사용이 부적합한 것으로 판단되며, 기후 변화에 따른 환경적 요소의 변화가 적은 해역에서 사용하기 적합할 것으로 보인다.
B
저서성 유공충 비율(B)은 세 가지의 조건, 즉 표층에서 유입되는 먹이 공급량, 수심, 탄산염 용해 정도에 따라 변한다(Berger and Diester-Haass, 1988). 저서성 유공충은 해저로 공급되는 유기물이 증가할수록 개체 수가 증가하기 때문에 표층 생산성과 밀접한 관련을 가지며, 생산성을 나타내는 지표로도 사용된다(Berger and Diester-Haass, 1988; Kroon et al., 1993). 저서성 유공충은 수심이 깊어질수록 먹이 공급량이 감소하기 때문에 개체 수가 뚜렷하게 줄어들며, 수심 1,500 m 이상에서 B는 크게 변하지 않는다(Berger and Diester-Haass, 1988). 따라서 연안에서 멀어지고 수심이 깊어질수록 생산성은 B의 변화에 크게 영향을 미치지 않기 때문에, 수심이 깊고 생산성이 낮으며 연안의 영향이 거의 없는 해역에서 유용하게 사용 가능하다.
B는 중앙태평양 적도해역에서 가장 낮고 북서태평양 해역에서 가장 높게 나타난다(MC 090301: 0-3%, MC 5111: 5-6%, MC 5107: 5-13%, NPGP 1302-1B: 3-16%) (그림 3d, 4d, 5d, 6d). 저서성 유공충 비율이 높은 NPGP 1302-1B와 MC 5107에서 B 함량 변화는 FLS의 변화 양상과 대체로 유사하게 나타난다(그림 3d, 5d). 한편, 저서성 유공충 비율이 10% 이하로 낮은 MC 090301과 MC 5111에서는 B의 변화가 FLS와 잘 일치하지 않는다(그림 4d, 6d). 이러한 결과로 보아 저서성 유공충의 함량 자체가 매우 낮은 빈영양 해역의 경우 B의 용해 지표로의 신뢰도는 비교적 낮다고 판단된다. 따라서 B는 연안으로부터 유기물의 공급량이 거의 없고, 그 함량이 비교적 높게 나타나는 해역에서 용해 지표로 사용이 적합할 것으로 판단된다.
FDX, Res
FDX와 Res는 유공충 종조성을 이용한 방법 중 신뢰성이 높은 것으로 알려져 있다(Conan et al., 2002). 두 지표는 방법에 있어서 약간의 차이는 있으나, 부유성 유공충 종의 용해 민감도를 이용하기 때문에 산출값은 대체적으로 일치한다(그림 3, 4, 5, 6).
쿠로시오 확장역(NPGP 1302-1B)에서 이 두 지표는 FLS와 반대의 변화 양상을 보인다(그림 3e). 이 해역은 아열대-아한대 경계부에 위치하여 기후변화에 민감하게 반응하는 해역이기 때문에, 이에 따라 유공충의 군집조성이 변화한다(Seo et al., 2018). 따라서 이 해역에서 FDX와 Res는 용해보다는 환경 변화에 따른 종조성의 변화가 반영된 것으로 해석된다. 예를 들면, 상부로 갈수록 FDX와 Res값이 감소하는 경향은 해빙기 이후 쿠로시오 난류의 영향이 강해지면서 용해에 강한 종(N. incompta나 N. dutertrei 등)의 비율이 감소한 결과로 해석된다(Seo et al., 2018). 동태평양 적도 해역(MC 5107)의 특정 시기(약 15 ka 이전, 그림 5e)에서 FDX와 Res값이 증가한 이유도 이 시기 동안 동태평양에서 발생한 강한 용승(Calvo et al., 2011)으로 인하여 용해에 강한, 표층생산성이 높은 해역을 선호하는 종이 번성했기 때문으로 판단된다. 한편, 해양 환경의 변화가 크지 않고 열대 빈영양 해역 지시종이 우점하는 중앙태평양 적도해역(MC 090301)의 경우에는 FDX와 Res가 FLS와 좋은 상관성을 보인다. 따라서 쿠로시오 확장역과 같이 용해의 영향이 적고 환경에 따른 유공충의 군집 구조 변화가 크다고 알려진 해역에서는 Res와 FDX가 용해 강도보다는 환경변화에 따른 종조성 변화의 영향을 반영할 가능성이 높은 것으로 판단된다.
6. 결 론
본 연구에서는 대륙의 영향이 비교적 작은, 서로 다른 원양성 환경에서 획득한 네 점의 퇴적물 코어에서 다섯 가지의 탄산염 용해 지표(CaCO3, CSF, B, FDX, Res)들을 분석하고, 용해 정도를 가장 잘 지시하는 것으로 알려진 파편도(FLS)와 비교하였다. 해양 환경의 변화가 적고 부유성 유공충의 함량이 높은 해역(예, 중앙 태평양 적도 해역)에서는 대부분의 지표가 용해 정도를 잘 지시하는 반면, 환경 변화의 폭이 크거나 수심이 낮은 해역(예, 쿠로시오 확장역 또는 동태평양 적도해역)에서는 용해 지표에 따라 탄산염 용해 보다는 표층생산성이나 대륙 기원 입자의 희석 등 환경 변수가이 지표 값에 더 큰 영향을 미치는 것으로 나타났다. CaCO3와 CSF는 유공충 외에도 다른 성분의 희석 효과를 크게 반영하므로, 대륙 기원 퇴적물이나 생물 기원 오팔이나 석회미세조류 등의 함량과 그 변화 폭이 큰 지역에서 용해 지표로서 활용되기 어렵다고 판단된다. B는 연안으로부터의 유기물 공급이 거의 없는 연구 해역의 경우 저서성 유공충 함량이 비교적 높은 지역에 적합한 방법으로 여겨진다. 유공충의 종 조성을 이용한 Res와 FDX는 용해를 강하게 받은 지역에서 보다 적합하고, 용해의 영향이 적은 해역에서는 환경 변화에 따른 유공충의 종 조성 변화가 값에 더 큰 영향을 미칠 수 있는 것으로 파악되었다.
Acknowledgments
본 연구는 이유리의 경북대학교 박사학위과정 중 생산한 데이터를 이용하였고 해양수산부(PM61151)와 한국해양과학기술원(PE99724, PE99711)의 연구비 지원에 의해 수행되었습니다. 논문을 검토하고 많은 조언을 주신 편집위원과 심사위원께 감사 드립니다.
References
-
Archer, D. and Maier-Reimer, E., 1994, Effect of deep-sea sedimentary calcite preservation on atmospheric CO2 concentration. Nature, 367, 260-263.
[https://doi.org/10.1038/367260a0]

- Arrhenius, G., 1952, Volume 5. Sediment cores from the East Pacific. In: Pettersson, H., Jerlov, N. and Kullenberg, B. (eds.), Reports of the Swedish Deep Sea Expedition 1947-48, 227 p.
-
Berger, W.H., 1968, Planktic foraminifera: selective solution and paleoclimatic interpretation. Deep-Sea Research, 15, 31-43.
[https://doi.org/10.1016/0011-7471(68)90027-2]

-
Berger, W.H., 1970, Planktic foraminifera: selective solution and the lysocline. Marine Geology, 8, 111-138.
[https://doi.org/10.1016/0025-3227(70)90001-0]

-
Berger, W.H., 1971, Sedimentation of planktic foraminifera. Marine Geology, 11, 325-358.
[https://doi.org/10.1016/0025-3227(71)90035-1]

-
Berger, W.H., Adelseck, C.G.J. and Mayer, L.A., 1976, Distribution of carbonate in surface sediments of the Pacific Ocean. Journal of Geophysical Research, 81, 2617-2627.
[https://doi.org/10.1029/JC081i015p02617]

-
Berger, W.H. and Diester-Haass, L., 1988, Paleoproductivity: the benthic/planktic ratio in foraminifera as a productivity index. Marine Geology, 81, 15-25.
[https://doi.org/10.1016/0025-3227(88)90014-X]

-
Berger, W.H. and Piper, D.J.W., 1972, Planktic foraminifera: Differential settling, dissolution, and redeposition. Limnology and Oceanography, 17, 275-287.
[https://doi.org/10.4319/lo.1972.17.2.0275]

-
Biscaye, P.E., Turekian, K.K. and Kolla, V., 1976, Distribution of calcium carbonate in surface sediments of the Atlantic Ocean. Journal of Geophysical Research, 81, 2595-2603.
[https://doi.org/10.1029/JC081i015p02595]

-
Bordiga, M., Cobianchi, M., Lupi., C., Pelosi, N., Venti, N.L. and Ziveri, P., 2014, Coccolithophore carbonate during the last 450ka in the NW Pacific Ocean (ODP site 1209B, Shatsky Rise). Journal of Quaternary Science 29, 57-69.
[https://doi.org/10.1002/jqs.2677]

-
Broecker, W.S. and Clark, E., 1999, CaCO3 size distribution: a paleocarbonate ion proxy?. Paleoceanography, 14, 596-604.
[https://doi.org/10.1029/1999PA900016]

-
Broecker, W.S. and Olson, E.A., 1961, Lamont radiocarbon measurements VIII. Radiocarbon, 3, 176-204.
[https://doi.org/10.1017/S0033822200020920]

-
Burr, G.S., Beck, J.W., Corrège, T., Cabioch, G., Taylor, F.W. and Donahue, D.J., 2009, Modern and Pleistocene Reservoir Ages Inferred from South Pacific Corals. Radiocarbon, 51, 319-335.
[https://doi.org/10.1017/S0033822200033853]

-
Calvo, E., Pelejero, C., Pena, L.D., Cacho, I. and Logan, G.A., 2011, Eastern Equatorial Pacific productivity and related-CO2 changes since the last glacial period. Proceedings of the National Academy of Sciences, 108, 5537-5541.
[https://doi.org/10.1073/pnas.1009761108]

-
Chaisson, W., 1995, Planktonic Foraminiferal Assemblages and Paleoceanographic Change in the Trans-tropical Pacific Ocean: A Comparison of West (Leg 130) an East (Leg 138), Latest Miocene to Pleistocene. In: Pisias, N.G., Mayer, L.A., Janecek, T.R., Palmer-Julson, A. and van Andel, T.H. (eds.), Proceedings of the Ocean Drilling Program, Scientific Results, 138, 555-597.
[https://doi.org/10.2973/odp.proc.sr.138.129.1995]

-
Chiu, T.-C. and Broecker, W.S., 2008, Toward better paleocarbonate ion reconstructions: New insights regarding the CaCO3 size index. Paleoceanography, 23, PA2216.
[https://doi.org/10.1029/2008PA001599]

-
Conan, S.M.H., Ivanova, E.M. and Brummer, G.J.A., 2002, Quantifying carbonate dissolution and calibration of foraminiferal dissolution indices in the Somali Basin. Marine Geology, 182, 325-349.
[https://doi.org/10.1016/S0025-3227(01)00238-9]

-
Ding, X., Bassinot, F., Guichard, F., Li, Q.Y., Fang, N.Q., Labeyrie, L. and Hardjawidjaksana, K., 2006, Distribution and ecology of planktic foraminifera from the seas around the Indonesian Archipelago. Marine Micropaleontology, 58, 114-134.
[https://doi.org/10.1016/j.marmicro.2005.10.003]

- Emerson, S. and Bender, M, 1981, Carbon fluxes at the sediment water interface of the deep-sea: calcium carbonate preservation. Journal of Marine Research, 39, 139-162.
-
Martinez, J.I., 1994, Late Pleistocene Dissolution Cycles in the Vanuatu Region, Western Pacific Ocean. In: Greene, H.G., Collot, J.Y., Stokking, L.B. et al. (eds.), Proceedings of the Ocean Drilling Program, Scientific results, 134, 293-308.
[https://doi.org/10.2973/odp.proc.sr.134.012.1994]

-
Hancock, H.J. and Dickens, G.R., 2006, Carbonate dissolution episodes in Paleocene and Eocene sediment, Shatsky Rise, west-central Pacific. In: Bralower, T.J., Premoli Silva, I. and Malone, M.J. (eds.), Proceedings of the Ocean Drilling Program, Scientific Results, 198, 1-24.
[https://doi.org/10.2973/odp.proc.sr.198.116.2005]

-
Hays, J.D. and Peruzza, A., 1972, The significance of calcium carbonate oscillations in Eastern Equatorial Atlantic deep-sea sediments for the end of the Holocene warm interval. Quaternary Research, 2, 355-362
[https://doi.org/10.1016/0033-5894(72)90058-0]

-
Honjo, S, 1982, Seasonality and interaction of biogenic and lithogenic particulate flux at the Panama Basin. Science, 218, 883-884.
[https://doi.org/10.1126/science.218.4575.883]

-
Iwasaki, S., Kimoto, K., Sasaki, O., Kano, H., Honda, M.C. and Okazaki, Y., 2015, Observation of the dissolution process of Globigerina bulloides tests (planktic foraminifera) by X‐ray microcomputed tomography. Paleoceanography, 30, 317- 331.
[https://doi.org/10.1002/2014PA002639]

-
Kawahata, H., Suzuki, A. and Ohta, H., 2000, Export fluxes in the western Pacific warm pool. Deep Sea Research I, 47, 2061-2091.
[https://doi.org/10.1016/S0967-0637(00)00025-X]

-
Khim, B.K., Kim, H.J., Cho, Y.S., Chi, S.B. and Yoo, C.M., 2012, Orbital variations of biogenic CaCO3 and opal abundance in the western and central equatorial Pacific Ocean during the Late Quaternary. Terrestrial Atmospheric and Oceanic Sciences, 23, 107-117.
[https://doi.org/10.3319/TAO.2011.07.05.01(Oc)]

-
Kroon, D., Alexander, I. and Darling, K., 1993, Planktonic and benthic foraminiferal abundances and their ratios (P/B) as expressions of mid-late Quaternary changes in water mass distribution and flow intensity. In: McKenzie, J.A., Davies, P.J., Palmer-Julson, A., et al. (eds.), Proceedings of the Ocean Drilling program, Scientific Results, 133, 181-188.
[https://doi.org/10.2973/odp.proc.sr.133.231.1993]

-
Kimoto, K., Takaoka, H., Oda, M., Ikehara, M., Matsuoka, H., Okada, M., Oba, T. and Taira, A., 2003, Carbonate dissolution and planktic foraminiferal assemblages observed in three piston cores collected above the lysocline in the western equatorial Pacific. Marine Micropaleontology, 47, 227-251.
[https://doi.org/10.1016/S0377-8398(02)00118-4]

-
Kucera, M., 2007, Planktonic foraminifera as tracers of past oceanic environments, Chapter 6. In: Developments in Marine Geology, Elsevier, 1, 213-262.
[https://doi.org/10.1016/S1572-5480(07)01011-1]

-
Le, J. and Shackleton, N.J., 1992, Carbonate dissolution fluctuations in the western equatorial Pacific during the late Quaternary. Paleoceanography, 7, 21-42.
[https://doi.org/10.1029/91PA02854]

-
Li, B. and Jian, Z., 2001, Evolution of planktic foraminifera and thermocline in the southern South China Sea since 12 Ma (ODP-184, Site 1143). Science in China Series D: Earth Sciences, 44, 889-896.
[https://doi.org/10.1007/BF02907080]

-
Lisitsin, A.P., 1996, Oceanic Sedimentation: Lithology and Geochemistry. American Geophysical Union, 400 p.
[https://doi.org/10.1029/SP044]

- Locarnini, R.A., Mishonov, A.V., Baranova, O.K., Boyer, T.P., Zweng, M.M., Garcia, H.E., Reagan, J.R., Seidov, D., Weathers, K., Paver, C.R. and Smolyar, I., 2018, World Ocean Atlas 2018, Volume 1: Temperature. In: Mishonov A. (ed), NOAA Atlas NESDIS 81, 52 p.
-
Malmgren, B.A., 1983, Ranking of dissolution susceptibility of planktic foraminifera at high latitudes of the South Atlantic Ocean. Marine Micropaleontology, 8, 183-191.
[https://doi.org/10.1016/0377-8398(83)90023-3]

-
McCarthy, F.M.G., Findlay, D.J. and Little, M.L., 2004, The micropaleontological character of anomalous calcareous sediments of late Pliocene through early Pleistocene age below the CCD in the northwestern North Pacific Ocean. Palaeogeography, Palaeoclimatology, Palaeoecology, 215, 1-15.
[https://doi.org/10.1016/S0031-0182(04)00402-X]

-
Mekik, A.F., Noll, N. and Russo, M., 2010, Progress toward a multi-basin calibration for quantifying deep sea calcite preservation in the tropical/subtropical world ocean. Earth and Planetary Science Letters, 299, 104-117.
[https://doi.org/10.1016/j.epsl.2010.08.024]

-
Mekik, F.A., Loubere, P.W. and Archer, D.E., 2002, Organic carbon flux and organic carbon to calcite flux ratio recorded in deep-ea carbonates: Demonstration and a new proxy. Global Biogeochemical Cycles, 16, 1052.
[https://doi.org/10.1029/2001GB001634]

-
Murray, R.W. and Leinen, M., 1993, Chemical transport to the seafloor of the equatorial Pacific Ocean across a latitudinal transect at 135 W: tracking sedimentary major, trace, and rare earth element fluxes at the Equator and the Intertropical Convergence Zone. Geochimica et Cosmochimica Acta, 57, 4141-4163.
[https://doi.org/10.1016/0016-7037(93)90312-K]

-
Naik, S.S. and Naidu, P.D., 2010, Evaluation of the CaCO3 dissolution proxies in sediment cores from above the lysocline. Quaternary International, 213, 69-73.
[https://doi.org/10.1016/j.quaint.2008.11.009]

-
Olausson, E., 1965, Evidence of climatic changes in North Atlantic deep-sea cores, with remarks on isotopic paleotemperatures analysis. Progress in Oceanography, 3, 221-252.
[https://doi.org/10.1016/0079-6611(65)90020-0]

-
Parker, F.L. and Berger, W.H., 1971, Faunal and solution patterns of planktic foraminifera in surface sediments of the South Pacific. Deep Sea Research, 18, 73-107.
[https://doi.org/10.1016/0011-7471(71)90017-9]

-
Petchey, F., Anderson, A., Zondervan, A., Ulm, S. and Hogg, A., 2008, New marine ΔR values for the South Pacific subtropical gyre region. Radiocarbon, 50, 373-397.
[https://doi.org/10.1017/S0033822200053509]

-
Peterson, L.C. and Prell, W.L., 1985, Carbonate dissolution in recent sediments of the eastern equatorial Indian Ocean: Preservation patterns and carbonate loss above the lysocline. Marine Geology, 64, 259-290.
[https://doi.org/10.1016/0025-3227(85)90108-2]

-
Pfuhl, H.A. and Shackleton, N.J., 2004, Two proximal, high-resolution records of foraminiferal fragmentation and their implications for changes in dissolution. Deep-Sea Research I, 51, 809-832.
[https://doi.org/10.1016/j.dsr.2004.02.003]

-
Reimers, C.E. and Wakefield, W.W., 1989, Flocculation of siliceous detritus on the sea floor of a deep Pacific seamount. Deep Sea Research Part A. Oceanographic Research Papers, 36, 1841-1861.
[https://doi.org/10.1016/0198-0149(89)90115-5]

-
Reimer, P.J. et al. and Marine13 radiocarbon age calibration curves 0-50,000 years cal BP. Radiocarbon, 55, 1869-1887.
[https://doi.org/10.2458/azu_js_rc.55.16947]

-
Rottman, M.L., 1979, Dissolution of planktic foraminifera and pteropods in south China Sea sediments. Journal of Foraminiferal Research, 9, 41-49.
[https://doi.org/10.2113/gsjfr.9.1.41]

- Ruddiman, W.F. and Heezen, B.C., 1967, Differential solution of planktic foraminifera. Deep Sea Research II, 47, 2629-2651.
- Schott, W., 1935, Die Forminiferen in dem äquatorialen Teil des Atlantischen Ozeans. Deutsche Atlantische Expedition, 6, 411-616.
-
Seo, I., Lee, Y., Lee, Y.I., Yoo, C.M. and Hyeong, K., 2016, Climatic evolution of the central equatorial Pacific since the Last Glacial Maximum. Geochemistry, Geophysics, Geosystems, 17, 3454- 3468.
[https://doi.org/10.1002/2016GC006371]

-
Seo, I., Lee, Y., Yoo, C.M. and Hyeong, K., 2018, Migration of the Kuroshio Extension in the Northwest Pacific since the Last Glacial Maximum. Palaeogeography, Palaeoclimatology, Palaeoecology, 496, 323-331.
[https://doi.org/10.1016/j.palaeo.2018.01.048]

- Stuiver, M., Reimer, P.J. and Reimer, R.W., 2017. CALIB 7.1 [WWW program] Retrieved from: http://calib.org.accessed, , 5-25.
-
Thunell, R.C., 1976, Optimum indices of calcium carbonate dissolution in deep-sea sediments. Geology, 4, 525-528.
[https://doi.org/10.1130/0091-7613(1976)4<525:OIOCCD>2.0.CO;2]

-
Volat, J.L., Pastouret, L. and Vergnaud-Grazzini C., 1980, Dissolution and carbonate fluctuations in Pleistocene deep-sea cores: a review. Marine Geology, 34, 1-28.
[https://doi.org/10.1016/0025-3227(80)90138-3]

-
Yamane, M., 2003, Late Quaternary variations in water mass in the Shatsky Rise area, northwest Pacific Ocean. Marine Micropaleontology, 48, 205-223.
[https://doi.org/10.1016/S0377-8398(03)00017-3]

-
Zaunbrecher, L.K., Cobb, K., Beck, J.W., Charles, C.D., Druffel, E.R.M., Fairbanks, R.G., Griffin, S. and Sayani, H.R., 2010, Coral records of central tropical Pacific radiocarbon variability during the last millennium. Palaeoceanography, 25, PA4212.
[https://doi.org/10.1029/2009PA001788]