지표환경에서의 마그네슘 동위원소 분별
초록
최근 분석법 및 질량분석기의 발달로 인해 비전통 안정동위원소의 지구과학적 활용이 두드러지지만, 이에 대한 국내에서의 활용은 미진한 실정이다. 마그네슘 동위원소는 전 지구적 탄소순환, 해수 화학, 양분순환(nutrient cycling)을 이해하는 지시자로 활용될 수 있으며, 이를 위해서는 Mg 순환과정 중 발생하는 동위원소 분별에 대한 이해가 선행되어야 한다. 따라서 본 논평에서는 지표환경에서 마그네슘 동위원소 분별을 일으키는 요인(주요 광물 용해, 이차광물 생성, 흡착, 식물 섭취 및 탄산염 광물 침전)에 대하여 소개하고자 한다. 먼저 마그네슘 동위원소의 개념, 질량분석기를 활용한 분석법을 살펴보고 마지막으로 최근 연구결과를 통한 지표환경에서 마그네슘 동위원소 분별을 일으키는 요인 및 기작에 대하여 살펴보고자 한다.
Abstract
With the advent of analytical technique and mass spectrometry, non-traditional stable isotopes have been widely used in earth and environmental sciences. However, little studies have been conducted in South Korea. Magnesium (Mg) isotopes can be used as a tracer for understanding global climate change, seawater chemistry and nutrient cycling in soil. To this end, Mg isotope fractionation during geological Mg cycling should be quantified. This review introduces major factors (primary mineral dissolution, secondary mineral formation, adsorption, plant uptake and carbonate mineral precipitation) causing Mg isotope fractionation during surficial processes. This review also introduces the principle of Mg isotopes and analytical methods. Finally, recent studies are reviewed in order to see how and to what extent Mg isotope fractionation would occur according to each factor.
Keywords:
Magnesium isotope, isotope fractionation, surficial process키워드:
Mg 동위원소, 동위원소 분별, 지표환경1. 서 론
규산염 암석의 화학적 풍화는 대기 중 이산화탄소와 반응을 통해 다양한 용존 물질(특히, 칼슘과 마그네슘)을 강을 통하여 바다로 유입시킨다. 바다에 유입된 용존 물질은 탄산염 광물로 침전되면서 백만년 단위의 지질학적 시간규모에서 전 지구적 탄소순환 및 기후를 조절하는 역할을 한다(Berner et al., 1983). 또한, 마그네슘(Mg)은 엽록소 합성에 이용되는 필수적인 식물의 영양원소이다(Epstein and Bloom, 2005).
Mg는 원자번호 12번의 원소로, 알칼리 토금속(주기율표의 2족) 원소 중 하나이다. 순수한 Mg는 은백색 금속으로 대기압상에서 650℃의 녹는점과 1090℃의 끓는점을 가진다. 낮은 이온화 에너지를 갖는 전자배치(electric configuration; [Ne]3s2)로 인하여 Mg는 +2의 원자가 전자(valance state)와 0.72Å의 이온반경을 가진다(Shannon, 1976).
Mg는 주요 원소로 지각, 수권, 생물권에 널리 분포하며, 지구 내 4번째 원소(MgO=25.5 wt%; McDonough and Sun, 1995), 지각 내 5번째 원소(MgO=4.66 wt%; Rudnick and Gao, 2003), 해수 내 2번째 원소(Mg=0.128 wt%; Pilson, 2013)이다. 그럼에도 불구하고, 지구상 Mg의 99.9% 이상이 맨틀에 존재한다(McDonough and Sun, 1995).
Mg는 24, 25, 26의 질량수를 갖는 3개의 안정동위원소를 가지며, 자연 상태에서 각각의 존재비는 78.99%, 10.00%, 11.01% (Berglund and Wieser, 2011)이고, 평균원자량은 24.305 (CIAAW, 2015)이다. 질량분석기의 한계로 인해 과거 Mg 동위원소 연구는 단수명(short-lived) 26Al의 붕괴로 생성되는 방사기원 26Mg를 구하는 질량 비상관(mass-independent) 동위원소 이상치(Lee and Papanastassiou, 1974) 또는 증발에 의한 큰 동력학적 질량상관 동위원소 분별(Russell et al., 1998)에 중점을 두었다. 최근 분석기술과 다검출기 유도결합 플라즈마 질량분석기(multi-collector inductively coupled plasma mass spectrometry; MC-ICP-MS)의 발달로 인해 자연계 Mg 동위원소 변화(variation)를 구분할 수 있는 초정밀 Mg 동위원소(δxMg (‰) = ((xMg/24Mg)sample/ (xMg/24Mg)DSM3-1)*1000, DSM3은 Mg 동위원소 표준물질; x = 25, 26) 분석이 가능해졌다. 현재까지 26Mg/24Mg에 대한 7‰ 이상의 동위원소 변화가 있음이 보고되었고, 일반적으로 탄산염은 가벼운 동위원소 조성(최소 -5.6‰; Wombacher et al., 2011)을 갖고 풍화된 규산염은 무거운 동위원소 조성(최대 +1.8‰; Liu et al., 2014)을 갖는다(그림 1). 다른 안정동위원소와 유사하게 Mg 동위원소는 저온의 지표환경에서 큰 동위원소 분별이 일어나지만 고온환경에서 동위원소 분별이 거의 일어나지 않는다. 이는 온도가 증가함에 따라 분자간 영점 진동 에너지(zero-point vibrational energy; ZPE)가 감소하기 때문이다(Urey, 1947).
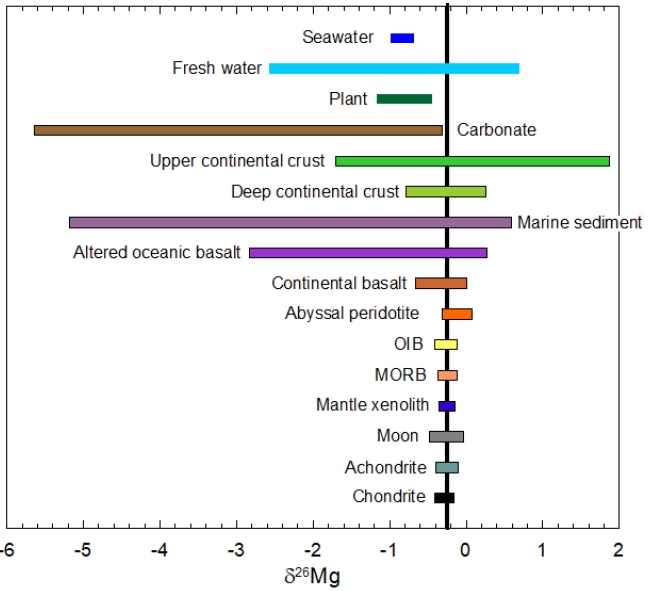
Magnesium isotopic distribution in major extraterrestrial and terrestrial reservoirs. The vertical line represents the average Mg isotopic composition of bulk Earth (δ26Mg = -0.25‰ Teng et al., 2010) (modified from Teng, 2017).
이 논평에서는 MC-ICP-MS를 활용한 분석법을 간단히 설명하고, 지표환경에서 Mg 동위원소 분별을 일으키는 주요 요인들에 의한 분별 정도 및 기작에 대하여 살펴볼 것이다.
2. Mg 동위원소 분석법
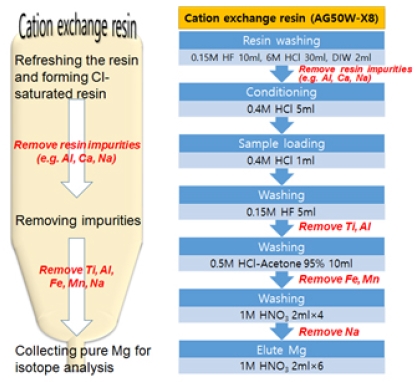
Mg 분리 및 MC-ICP-MS를 활용한 동위원소 분석방법은 Choi et al. (2013)에 의해 자세히 보고되었다. 요약하자면, 양이온 교환수지(Bio-rad, AG-50W-X8 resin, 200-400 mesh)를 이용하여 다음 과정을 통해 시료 내 Mg를 분리한다(그림 2).
- ① 10 µg 이상의 Mg를 포함한 시료를 0.4N 염산 0.5 mL로 준비한다.
- ② 0.15N 불산 5 mL를 넣어 시료 내 Al과 Ti를 제거한다.
- ③ 0.5N 염산-95% 아세톤 혼합용액 10 mL를 넣어 시료 내 Fe와 Mn을 제거한다.
- ④ 1N 질산 8 mL를 넣어 시료 내 Na을 제거한다.
- ⑤ 1N 질산 12 mL를 넣어 순수한 Mg만 분리한다.
Mg 동위원소 비는 MC-ICP-MS를 이용하여 분석하며, 분석 중 발생할 수 있는 기기 질량편이(instrumental mass bias)는 Mg 동위원소 표준물질인 DSM-3을 이용한 표준물질-시료-표준물질의 외부 보정법을 사용하여 보정한다. 이때 시료와 동위원소 표준물질의 농도는 반드시 10% 이내에서 일치해야 농도차이에 따른 동위원소 분별효과를 제거할 수 있다(Huang et al., 2009). 분석된 Mg 동위원소 비는 DSM-3에 대한 델타표기법(δ-notation)으로 다음과 같이 보고하며, 시료당 최소 2번 이상의 반복분석을 실시하여 분석정밀도를 2σ로 보고한다.
3. Mg 동위원소 분별 요인
26Mg와 24Mg간 8% 이상의 큰 질량차로 인하여 다양한 생지구화학적 반응에 의해 상당한 동위원소 분별이 일어날 수 있고, 현재까지 보고된 주요 지구상 물질의 δ26Mg값 차이(7.4‰; Teng, 2017)는 이를 뒷받침한다(그림 1). 이 장에서는 지표환경에서 동위원소 분별을 일으키는 주요 요인들: 1) 주요 광물 용해(primary mineral dissolution), 2) 이차광물 생성(secondary mineral formation), 3) 흡착(adsorption), 4) 식물 섭취(plant uptake), 5) 탄산염 광물 침전(carbonate mineral precipitation)에 의한 동위원소 분별 정도 및 기작에 대하여 소개하였다. 이를 통하여 지구상 물질의 Mg 동위원소 차이를 이해하고, 향후 다양한 학문분야에 Mg 동위원소를 적용할 수 있는 기틀을 제공하고자 하였다.
3.1 주요 광물 용해(primary mineral dissolution)
주요 광물이 용해될 때 두 가지 과정에 의해 Mg 동위원소 분별이 얼어난다고 보고되었다(Wimpenny et al., 2010; Ryu et al., 2011). Wimpenny et al. (2010)은 반응용액을 비평형상태(far-from equilibrium)로 유지하기 위하여 pH = 2~4 조건에서 현무암질 유리(basalt glass)와 감람석(olivine)에 대한 배치용해실험을 수행하였다. 반응용액의 리튬(Li) 동위원소 조성은 초기 반응물질인 현무암질 유리와 감람석의 동위원소 조성과 일치한 반면, Mg 동위원소 조성은 초기 반응물질인 현무암질 유리와 감람석에 비해 가벼운 동위원소가 부화된 특성을 보이며 반응시간에 따라 점차 낮아지는 특성을 보였다. 즉, 주요 광물 용해에 의해 가벼운 동위원소가 우선적으로 반응용액으로 용출됨을 제시하였다.
Ryu et al. (2011)은 pH = 1 조건의 비평형상태에서 흑운모(8.4 wt.%), 녹니석(1.5 wt.%), 감섬석(1.0 wt.%)을 포함한 화강섬록암(granodiorite)을 이용하여 플러그 플로(plug flow) 용해실험을 수행하였다. 광물의 δ26Mg 값은 각각 -0.29‰, -0.32‰, -1.82‰이며, 반응용액의 δ26Mg 값은 반응 초기 -1.59‰에서 반응시간에 따라 -0.17‰까지 증가하였다. 이러한 반응용액의 δ26Mg 값은 Mg 동위원소 조성과 용해 속도(dissolution rate)가 각기 다른 세 광물의 혼합(mixing)에 의한 결과로 제시하였다.
3.2 이차 광물 생성(secondary mineral formation)
강 및 토양의 Mg 동위원소 조성은 맨틀의 Mg 동위원소 조성과 상당히 다르며, 이는 화학적 풍화에 의한 동위원소 분별의 영향으로 보고되었다(Tipper et al., 2006, 2008, 2010, 2012a, 2012b; Pogge von Strandmann et al., 2008; Jacobson et al., 2010; Teng et al., 2010; Wimpenny et al., 2010; Huang et al., 2012; Opfergelt et al., 2012; Lee et al., 2014). 그럼에도 불구하고, 동위원소 분별이 일어나는 방향(direction)은 보고된 연구들마다 상이하고, 동위원소 분별을 일으키는 주요 요인들에 대해서도 아직까지는 논란의 여지가 있다. 규산염의 화학적 풍화에 의해 생성되는 이차 광물은 주로 점토광물이고, Mg는 주로 두 가지 형태로 점토광물 내 존재한다: 1) 팔면체 격자(octahedral lattice), 2) 광물 표면(mineral surface)이나 층간(interlayer).
Tipper et al. (2006)은 전 세계에 존재하는 45개 강(river)에 대한 Mg 동위원소 분석을 통하여 소규모 강의 용존 δ26Mg 값은 일반적으로 기반암의 특성을 반영하지만, 세계 주요 강의 용존 δ26Mg 값은 풍화에 의한 분별 특성을 반영한다고 보고하였다. 오직 규산염만 흐르는 강의 용존 δ26Mg 값이 기반암의 δ26Mg 값에 비해 평균 0.4‰ 낮은 것은 풍화 과정 중 가벼운 동위원소(24Mg)가 선택적으로 용출되고 무거운 동위원소(25Mg, 26Mg)는 토양 내 포획에 의한 것으로 제시하였다.
Teng et al. (2010)은 변휘록암(meta-diabase)에서 생성된 풍화 단면(weathering profile) 연구를 통하여 Mg 동위원소 분별은 단순 레일리 동위원소 분별(Rayleigh isotope fractionation)을 따르며, 이차 광물 생성에 의해 토양의 δ26Mg 값이 기반암에 비해 약 0.65‰ 부화됨을 보고하였다. 반면, Pogge von Strandmann et al. (2008)은 아이슬란드 강(river)에 대한 연구를 통하여 높은 pH (> 8)에서 생성된 활석(talc)과 녹니석(chlorite)은 가벼운 동위원소를 선택적으로 취하며, 상대적으로 낮은 pH (< 8)에서 생성된 스멕타이트(smectite)는 무거운 동위원소를 취한다고 제안하였다. 이러한 특성은 생성된 이차광물의 구조적 특성에 기인하는 것으로 판단하였다. Wimpenny et al. (2010)은 침전 실험을 통하여 온석면(chrysotile)이 생성되면서 가벼운 동위원소를 우선적으로 취한다고 보고하였다.
평형상태 동위원소 분별(equilibrium isotope fractionation)은 원자 질량이 결합 진동 에너지(bond vibrational energy)에 미치는 영향으로 발생하며, 분자의 영점 진동 에너지에 비례한다. 동위원소 분별 정도(magnitude)를 결정하는 가장 중요한 요인은 결합력(bond strength)의 차이이다. 즉, 강한 결합은 무거운 동위원소를 선호한다. 일반적으로 강한 결합은 높은 산화 상태(oxidation state), 공유 결합(covalent bonding), 낮은 배위수(coordination number)와 비례하며, 많은 동위원소 시스템에서 가벼운 동위원소는 선택적으로 큰 배위수를 갖는 위치로 분별된다(Schauble, 2004). 용존 Mg 이온(Mg2+)은 물 분자와 팔면체 형태로 배위하여 Mg-O 결합길이가 2.08Å인 팔면체 수화 이온 형태(Mg(H2O)62+)로 존재하며(Pavlov et al., 1998), 결합력은 팔면체 격자 내 Mg보다 약하다(Bock et al., 1994). 따라서 화학적 풍화에 의해 이차 광물이 생성될 때 무거운 동위원소는 팔면체 격자 내에 존재하게 되며 가벼운 동위원소는 수용액으로 빠져나가게 된다.
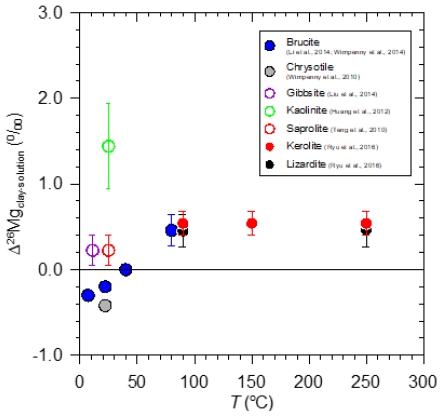
Wimpenny et al. (2014)은 팔면체 구조의 수활석(brucite) 합성실험을 통하여 팔면체 격자 내 무거운 동위원소가 결합됨을 확인하였고, 반응시간 10일 후 수활석과 반응용액의 δ26Mg값 차(Δ26Mgbrucite-solution)가 일정하게 약 0.5‰임을 확인하였다. Ryu et al. (2016)은 사면체판과 팔면체판이 1:1의 비율로 결합된 리자다이트(lizardite)와 두 장의 사면체판이 한 장의 팔면체판을 가운데 두고 2:1의 비율로 결합된 케로라이트(kerolite) 합성실험을 통하여 두 형태의 점토광물 모두 무거운 동위원소가 팔면체 격자 내에 결합됨을 확인하였다. 또한 광물의 형태 및 합성온도와 상관없이 반응 용액에 비해 점토광물의 δ26Mg 값이 약 0.5‰ 부화됨을 단순 레일리 동위원소 분별식을 이용하여 제시하였다. 실험연구를 통한 광물과 반응용액간 동위원소 분별 상수(isotope fractionation factor)는 기존 토양연구를 통해 얻은 결과(Teng et al., 2010; Huang et al., 2012)와 일치하였다(그림 3).
3.3 흡착(adsorption)
점토광물은 일반적으로 층(layer)이나 판(sheet)을 형성하는 Si-O 사면체와 Al-O 팔면체로 구성된다(Merkel and Planer-Friedrich, 2008). 점토광물 내 구조적 치환 반응(예, Al3+에 의한 Si4+ 치환, Mg2+에 의한 Al3+ 치환)은 음의 표면전하를 유도하여, 광물 표면이나 층간에 자유 양의 전하를 갖는 양이온을 흡착시킨다(Merkel and Planer-Friedrich, 2008). 이때 광물 표면에 용존 이온의 흡착은 상당한 동위원소 분별을 야기한다(Schwarcz et al., 1969). 예를 들어, 철 수산화물의 표면에 흡착으로 인해 철(Fe)은 최대 +0.85‰ (Δ56Fesorbed-aqueous), 구리(Cu)는 최대 +1.0‰ (Δ65Cusorbed-aqueous), 아연(Zn)은 최대 +0.53‰ (Δ66Znsorbed-aqueous)의 동위원소 분별이 일어남이 보고되었다(Balistrieri et al., 2008; Pokrovsky et al., 2008; Mikutta et al., 2009). 이러한 흡착에 의한 원소별 상이한 동위원소 분별 정도는 배위 환경의 차이에 의한 것으로 해석된다(Schauble, 2011).
점토광물 표면에 Mg2+ 흡착은 강한 화학적 결합을 형성하고 다양한 표면 착합체(surface complex)를 생성한다(Begum et al., 1998). 광물 표면이나 가장자리에 표면 착합체(실라놀(silanol; ≡SiOH), 알루미놀(aluminol; ≡AlOH)) 생성은 카올린광물(kaolin mineral)에 금속이온이 흡착되는 주요 경로이다(Ma and Eggleton, 1999). 카올리나이트(kaolinite) 표면에 구리 흡착 연구를 통하여 구리 이온은 표면 착합체인 실라놀과 알루미놀에 각각 배위수 4와 2를 가지며 흡착됨을 제시하였다(Peacock and Sherman, 2005). Cu와 Mg는 이온 반경이 비슷하기 때문에 Mg2+ 역시 비슷한 배위수를 가지며 흡착될 것으로 제시하였다(Huang et al., 2012). 따라서 카올린광물의 Mg-O 결합은 Mg 수화이온의 Mg-O 결합보다 강해 무거운 동위원소가 선택적으로 광물 표면에 흡착됨을 제시하였다(Huang et al., 2012).
Liu et al. (2014)은 현무암의 극한 풍화에 의한 보크사이트의 δ26Mg 값이 카올리나이트 및 헬로이사이트(halloysite)의 양(wt.%)과 음의 상관성을 보이지만 깁사이트(gibbsite)의 양과는 양의 상관성을 보임을 확인하였다. 이를 통하여 깁사이트는 무거운 동위원소를 선택적으로 취한다고 제시하였다.
Opfergelt et al. (2012)은 안산암 풍화에 의해 생성된 전 토양(bulk soil)과 점토 광물의 Mg 동위원소 분석을 통하여 점토광물이 기반암보다 무거운 동위원소가 부화되었음을 보여주었다(그림 4a). 또한, 전 토양의 δ26Mg 값이 교환성(exchangeable) Mg 양과 반비례함을 통하여 교환성 착합체(exchangeable complex)의 Mg 흡착은 가벼운 동위원소를 선호함을 제시하였다(그림 4b). Opfergelt et al. (2014)는 아이슬란드 토양에 대한 추가연구를 통하여 토양 내 점토광물(clay fraction), 토양 표면에 흡착된 교환성 Mg 및 토양수(soil water) 모두 기반암에 비해 가벼운 동위원소가 부화되었음을 확인하였다. 이는 무거운 동위원소가 알로팬(allophane)과 페리하이드라이트(herrihydrite)와 같은 단축 정렬 광물(short-range ordered mineral)에 연속적으로 흡착과 탈착을 한 결과로 제시하였다(Huang et al., 2012). 그러나 Pogge von Strandmann et al. (2012)는 아이슬란드 토양수의 δ26Mg 값이 교환성(exchangeable) Mg 양과 반비례함은 교환성 착합체(exchangeable com-plex)는 무거운 동위원소의 흡착을 선호함을 제시하였다.
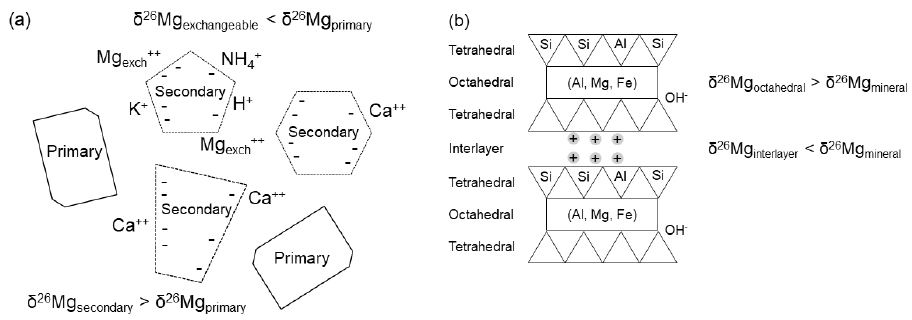
Conceptual diagram of Mg distribution and its isotopic variations: (a) Mg distribution and its isotopic variation in soil; (b) occurrence of Mg and its isotopic variation in the TOT Mg-clay (modified from Opfergelt et al., 2014).
Wimpenny et al. (2014)은 구조적으로 다른 3개 점토광물인 스멕타이트(smectite), 일라이트(illite), 카올리나이트(kaolinite)에 대한 용출실험을 통하여 무거운 동위원소는 팔면체 격자 내에 결합되며, 광물 표면이나 층간에 가벼운 동위원소가 흡착됨을 제시하였다. 다만, 광물 표면이나 층간의 교환성 Mg의 동위원소 조성은 광물 주변 용액의 Mg의 동위원소 조성을 반영하는 것이지 가벼운 동위원소의 선별적 흡착이 아님을 제시하였다. 지금까지 연구결과를 통하여 동위원소 분별의 방향(direction)과 상관없이 이차광물에 Mg의 흡착과 탈착은 모두 상당한 동위원소 분별(최대 1.8‰; Liu et al., 2014)을 야기함을 확인할 수 있다.
3.4 식물 섭취(plant uptake)
Mg는 생물권에서 필수적인 원소로 엽록소(chlorophyll) 합성과 식물 생장에 의해 상당한 동위원소 분별이 일어날 수 있다. Mg 동위원소를 생물학적 과정의 잠재적인 지시자로 활용하기 위해서는 생물학적 과정에 의한 동위원소 거동을 먼저 알아야 한다. 실험적으로 성장된 남조류(cyanobacteria), 석회비늘편모류(coccolithophore), 밀(wheat)에서 추출한 엽록소의 Mg 동위원소 분석을 통하여 엽록소는 배양액(growth media)에 비해 가벼운 동위원소가 부회된 특성을 가진다(Black et al., 2006, 2008; Ra et al., 2010). 반대로, 서양송악(English ivy)의 잎에서 추출된 엽록소는 잎에 비해 무거운 동위원소가 부화된 특성을 보인다(Black et al., 2007). 해양 홍조류(red algae)의 엽록소 역시 해수에 비해 무거운 동위원소가 부화된 특성을 보인다(Ra and Kitagawa, 2007). 그러므로 엽록소의 동위원소 분별은 식물 종과 자연환경에 따라 분별의 방향(direction)이 다름을 알 수 있다.
Black et al. (2008)은 실험실에 키운 식물의 δ26Mg 값이 배양액보다 높고, 식물 내에서도 씨앗과 수액(exudate)은 잎, 줄기, 뿌리에 비해 무거운 동위원소가 부화됨을 보고하였다. 이를 통하여 식물에 의한 Mg 흡수 및 식물 내 이동(transport)에 의해 동위원소 분별이 일어남을 제시하였다. Bolou-Bi et al. (2010)은 배양액과 금운모(phlogopite)에서 재배한 호밀(rye grass)과 토끼풀(clover)의 Mg 동위원소 분석을 통하여 식물 종과 배양물질에 따른 동위원소 분별 정도는 다르지만 식물은 무거운 동위원소를 선택적으로 흡수함을 보여주었다. 또한, 잎이 뿌리에 비해 무거운 동위원소가 부화된 특성은 유기분자 생성, Mg 이동, 내부 순환과 같은 생물학적 과정에 의한 것임을 제시하였다. 자연에서 채취한 시료 역시 식물 내 Mg 이동에 의해 최대 +1.66‰의 동위원소 분별이 일어남을 보고하였다(Bolou-Bi et al., 2012).
3.5 탄산염 광물 침전(carbonate mineral precipitation)
Mg는 해수 내 탄산염 광물 침전 및 많은 속성작용들의 핵심원소로써 해양 탄산염의 Mg 동위원소 조성은 과거 해수 조성(Foster et al., 2010; Higgins and Schrag, 2015), 전 지구적 Mg 순환(Tipper et al., 2006; Higgins and Schrag, 2010; Beinlich et al., 2014; Pogge von Stradmann et al., 2014), 대륙지각 풍화의 진화(Pokrovsky et al., 2011; Kasemann et al., 2014)를 이해하는 잠재적 지시자로 활용될 수 있다. 이러한 이유로 방해석(calcite), 마그네사이트(magnesite), 네스퀘호나이트(nesquehonite), 백운석(dolomite), 디핀자이트(dypingite), 수활석(brucite), 엡소마이트(epsomite)의 생성에 의한 Mg 동위원소 분별을 정량화하기 위한 실험적 연구가 많이 수행되었다(Immenhauser et al., 2010; Li et al., 2011, 2015; Mavromatis et al., 2012; Pearce et al., 2012; Wimpenny et al., 2014). Wimpenny et al. (2014)와 Li et al. (2011)를 제외한 대부분 연구에서 침전된 탄산염 광물에 가벼운 동위원소가 부화된 결과를 보였다. 이는 광물 격자 내 Mg-O 결합거리가 Mg 수화이온의 Mg-O 결합거리보다 길어 약한 결합력을 갖고 이로 인해 가벼운 동위원소를 선택적으로 취하기 때문이다. 예를 들어, 수활석, 마그네사이트, 백운석의 Mg-O 결합거리는 각각 2.100-2.093Å (Catti et al., 1995; Chakoumakos et al., 1997), 2.101Å (Schauble, 2011), 2.115Å (Antao et al., 2004)이고 Mg 수화이온의 결합거리는 2.08Å (Pavlov et al., 1998)이다. Mg함유 탄산염에 비해 방해석 침전시 강한 동위원소 분별(Δ26Mgcalcite-fluid=-3.5‰)은 칼슘(Ca)에 비해 절대적으로 양이 적은 Mg가 치환되어 팔면체 격자 내에 위치할 때 유발된 변형의 결과로 제시되었다. 그러나 네스퀘호나이트와 디핀자이트는 광물 격자 내 Mg-O 결합거리가 Mg 수화이온의 Mg-O 결합거리보다 짧음에도 가벼운 동위원소가 부화된 특성이 보였다. 현재까지 연구결과를 통하여 다양한 탄산염 종들의 무거운 동위원소 부화 특성은 다음과 같은 순서로 나타난다: 아라고나이트(aragonite)>백운석>마그네사이트>방해석.
4. 결 언
이 논평에서 지표환경에서 Mg 동위원소 분별을 일으키는 요인들: 1) 주요 광물 용해(primary mineral dissolution), 2) 이차광물 생성(secondary mineral formation), 3) 흡착(adsorption), 4) 식물 섭취(plant uptake), 5) 탄산염 광물 침전(carbonate mineral precipitation) 및 각 요인들에 의해 동위원소 분별이 일어나는 원리를 살펴보았다. 연구 사례를 살펴본 결과 각 요인들에 의한 동위원소 분별의 방향(direction)은 다르지만 각 요인들 모두 상당한 동위원소 분별을 야기함을 확인할 수 있다.
Acknowledgments
이 논문은 부경대학교 자율창의학술연구비(2019년)에 의하여 연구되었음.
References
-
Antao, S.M., Mulder, W.H., Hassan, I., Crichton, W.A. and Parise, J.B., 2004, Cation disorder in dolomite, CaMg(CO3)2, and its influence on the aragonite+magnesite ↔ dolomite reaction boundary. American Mineralogist, 89, 1142-1147.
[https://doi.org/10.2138/am-2004-0728]

-
Balistrieri, L.S., Borrok, D.M., Wanty, R.B. and Ridley, W.I., 2008, Fractionation of Cu and Zn isotopes during adsorption onto amorphous Fe(III) oxyhydroxide: experimental mixing of acid rock drainage and ambient river water. Geochimica et Cosmochimica Acta, 72, 311-328.
[https://doi.org/10.1016/j.gca.2007.11.013]

- Begum, S., Khan, F.U. and Qasiar, M.A., 1998, Effect of temperature on the adsorption of Mg2+ on kaolin from aqueous solutions and the stability constants for complex formation. Journal of Chemical Society of Pakistan, 20, 19-24.
-
Beinlich, A., Mavromatis, V., Austrheim, H. and Oelkers, E.H., 2014, Inter-mineral Mg isotope fractionation during hydrothermal ultramafic rock alteration-Implications for the global Mg-cycle. Earth and Planetary Science Letters, 392, 166-176.
[https://doi.org/10.1016/j.epsl.2014.02.028]

-
Berglund, M. and Wieser, M.E., 2011, Isotopic compositions of the elements 2009 (IUPAC Technical Report). Pure and Applied Chemistry, 83, 397-410.
[https://doi.org/10.1351/PAC-REP-10-06-02]

-
Berner, R.A., Lasaga, A.C. and Garrels, R.M., 1983, The carbonate-silicate geochemical cycle and its effect on atmospheric carbon dioxide over the past 100 million years. American Journal of Science, 283, 641-683.
[https://doi.org/10.2475/ajs.283.7.641]

-
Black, J.R., Epstein, E., Rains, W.D., Yin, Q.-Z. and Casey, W.H., 2008, Magnesium-isotope fractionation during plant growth. Environmental Science and Technology, 42, 7831-7836.
[https://doi.org/10.1021/es8012722]

-
Black, J.R., Yin, Q.Z. and Casey, W.H., 2006, An experimental study of magnesium-isotope fractionation in chlorophyll-a photosynthesis. Geochimica et Cosmochimica Acta, 70, 4072-4079.
[https://doi.org/10.1016/j.gca.2006.06.010]

-
Bock, C.W., Kaufman, A. and Glusker, J.P., 1994, Coordination of water to magnesium cations. Inorganic Chemistry, 33, 419-427.
[https://doi.org/10.1021/ic00081a007]

-
Bolou-Bi, E.B., Poszwa, A., Leyval, C. and Vigier, N., 2010, Experimental determination of magnesium isotope fractionation during higher plant growth. Geochimica et Cosmochimica Acta, 74, 2523-2537.
[https://doi.org/10.1016/j.gca.2010.02.010]

-
Bolou-Bi, E.B., Vigier, N., Poszwa, A., Boudot, J.-P. and Dambrine, E., 2012, Effects of biogeochemical processes on magnesium isotope variations in a forested catchment in the Vosges Mountains (France). Geochimica et Cosmochimica Acta, 87, 341-355.
[https://doi.org/10.1016/j.gca.2012.04.005]

-
Catti, M., Ferraris, G., Hull, S. and Pavese, A., 1995, Static compression and H disorder in brucite, Mg(OH)2, to 11 GPa: a powder neuron diffraction study. Physics and Chemistry of Minerals, 22, 200-206.
[https://doi.org/10.1007/BF00202300]

-
Chakoumakos, B.C., Loong, C.K. and Schultz, A.J., 1997, Low-temperature structure and dynamics of brucite. The Journal of Physical Chemistry B, 101, 9458-9462.
[https://doi.org/10.1021/jp972225a]

-
Choi, M.S., Ryu, J.-S., Lee, S.-W., Shin, H.S. and Lee, K.-S., 2012, A revisited method for Mg purification and isotope analysis using cool-plasma MC-ICP-MS. Journal of Analytical Atomic Spectrometry, 27, 1955-1959.
[https://doi.org/10.1039/c2ja30191a]

- CIAAW, 2015, http://ciaaw.org/atomic-weights.htm, .
- Epstein, E. and Bloom, A.J., 2005, Mineral Nutrition of Plants: Principles and Perspectives. 2nd ed. Sinauer Associates, Inc., Sunderland, 380 p.
-
Foster, G.L., Pogge von Strandmann, P.A.E. and Rae, J.W.B., 2010, Boron and magnesium isotopic composition of seawater. Geochemistry, Geophysics, Geosystems, 11.
[https://doi.org/10.1029/2010GC003201]

-
Higgins, J.A. and Schrag, D.P., 2010, Constraining magnesium cycling in marine sediments using magnesium isotopes. Geochimica et Cosmochimica Acta, 74, 5039-5053.
[https://doi.org/10.1016/j.gca.2010.05.019]

-
Higgins, J.A. and Schrag, D.P., 2015, The Mg isotopic composition of Cenozoic seawater-evidence for a link between Mg-clays, seawater Mg/Ca, and climate. Earth and Planetary Science Letters, 416, 73-81.
[https://doi.org/10.1016/j.epsl.2015.01.003]

-
Huang, F., Glessner, J., Ianno, A., Lundstrom, G. and Zhang, Z., 2009, Magnesium isotopic composition of igneous rock standards measured by MC-ICP-MS. Chemical Geology, 268, 15-23.
[https://doi.org/10.1016/j.chemgeo.2009.07.003]

-
Huang, K.-J., Teng, F.-Z., Wei, G.-J., Ma, J.-L. and Bao, Z.-Y., 2012, Adsorption- and desorption-controlled magnesium isotope fractionation during extreme weathering of basalt in Hainan Island, China. Earth and Planetary Science Letters, 359-360, 73-83.
[https://doi.org/10.1016/j.epsl.2012.10.007]

-
Immenhauser, A., Buhl, D., Richter, D., Niedermayr, A., Riechelmann, D., Dietzel, M. and Schulte, U., 2010, Magnesium isotope fractionation during low-Mg calcite precipitation in a limestone cave-Field study and experiments. Geochimica et Cosmochimica Acta, 74, 4346-4364.
[https://doi.org/10.1016/j.gca.2010.05.006]

-
Jacobson, A.D., Zhang, Z., Lundstrom, C. and Huang, F., 2010, Behavior of Mg isotopes during dedolomitization in the Madison Aquifer, South Dakota. Earth and Planetary Science Letters, 297, 446-452.
[https://doi.org/10.1016/j.epsl.2010.06.038]

-
Kasemann, S.A., Pogge von Strandmann, P.A.E., Prave, A.R., Fallick, A.E., Elliott, T. and Hoffmann, K.-H., 2014, Continental weathering following a Cryogenian glaciation: Evidence from calcium and magnesium isotopes. Earth and Planetary Science Letters, 396, 66-77.
[https://doi.org/10.1016/j.epsl.2014.03.048]

-
Lee, S.-W., Ryu, J.-S. and Lee, K.-S., 2014, Magnesium isotope geochemistry in the Han River, South Korea. Chemical Geology, 364, 9-19.
[https://doi.org/10.1016/j.chemgeo.2013.11.022]

-
Lee, T. and Papanastassiou, D.A., 1974, Mg isotopic anomalies in the Allende meteorite and correlation with O and Sr effects. Geophysical Research Letters, 1, 225-228.
[https://doi.org/10.1029/GL001i006p00225]

-
Li, W., Beard, B.L. and Johnson, C.M., 2011, Exchange and fractionation of Mg isotopes between epsomite and saturated MgSO4 solution. Geochimica et Cosmochimica Acta, 75, 1814-1828.
[https://doi.org/10.1016/j.gca.2011.01.023]

-
Li, W., Beard, BL., Li, C., Xu, H. and Johnson, C.M., 2015, Experimental calibration of Mg isotope fractionation between dolomite and aqueous solution and its geological implications. Geochimica et Cosmochimica Acta, 157, 164-181.
[https://doi.org/10.1016/j.gca.2015.02.024]

-
Liu, X.-M., Teng, F.-Z., Rudnick, R.L., McDonough, W.F. and Cummings, M., 2014, Massive magnesium depletion and isotopic fractionation in weathered basalts. Geochimica et Cosmochimica Acta, 135, 336-349.
[https://doi.org/10.1016/j.gca.2014.03.028]

-
Ma, C. and Eggleton, R.A., 1999, Cation exchange capacity of kaolinite. Clays and Clay Minerals, 47, 174-180.
[https://doi.org/10.1346/CCMN.1999.0470207]

-
Mavromatis, V., Pearce, C.R., Shirokova, L.S., Bundeleva, I.A., Pokrovsky, O.S., Benezeth, P. and Oelkers, E.H., 2012, Magnesium isotope fractionation during hydrous magnesium carbonate precipitation with and without cyanobacteria. Geochimica et Cosmochimica Acta, 76, 161-174.
[https://doi.org/10.1016/j.gca.2011.10.019]

-
McDonough, W.F. and Sun, S.S., 1995, The composition of the Earth. Chemical Geology, 120, 223-253.
[https://doi.org/10.1016/0009-2541(94)00140-4]

- Merkel, B. and Planer-Friedrich, B., 2008, Groundwater Geochemistry: A Practical Guide to Modeling of Natural and Contaminated Aquatic Systems. Springer Verlag, 200 p.
-
Mikutta, C., Wiederhold, J.G., Cirpka, O.A., Hofstetter, T.B., Bourdon, B. and Von Gunten, U., 2009, Iron isotope fractionation and atom exchange during sorption of ferrous iron to mineral surfaces. Geochimica et Cosmochimica Acta, 73, 1795-1812.
[https://doi.org/10.1016/j.gca.2009.01.014]

-
Opfergelt, S., Burton, K.W., Georg, R.B., West, A.J., Guicharnaud, R.A., Sigfusson, B., Siebert, C., Gislason, S.R. and Halliday, A.N., 2014, Magnesium retention on the soil exchange complex controlling Mg isotope variations in soils, soil solutions and vegetation in volcanic soils, Iceland. Geochimica et Cosmochimica Acta, 125, 110-130.
[https://doi.org/10.1016/j.gca.2013.09.036]

-
Opfergelt, S., Georg, R.B., Delvaux, B., Cabidoche, Y.M., Burton, K.W. and Halliday, A.N., 2012, Mechanisms of magnesium isotope fractionation in volcanic soil weathering sequences, Guadeloupe. Earth and Planetary Science Letters, 341, 176-185.
[https://doi.org/10.1016/j.epsl.2012.06.010]

-
Pavlov, M., Siegbahn, P.E. and Sandstrom, M., 1998, Hydration of beryllium, magnesium, calcium, and zinc ions using density functional theory. The Journal of Physical Chemistry A, 102, 219-228.
[https://doi.org/10.1021/jp972072r]

-
Peacock, C.L. and Sherman, D.M., 2005, Surface complexation model for multisite adsorption of copper(II) onto kaolinite. Geochimica et Cosmochimica Acta, 69, 3733-3745.
[https://doi.org/10.1016/j.gca.2004.12.029]

-
Pearce, C.R., Saldi, G.D., Schott, J. and Oelkers, E.H., 2012, Isotopic fractionation during congruent dissolution, precipitation and at equilibrium: Evidence from Mg isotopes. Geochimica et Cosmochimica Acta, 92, 170-183.
[https://doi.org/10.1016/j.gca.2012.05.045]

-
Pogge von Strandmann, P.A.E., Burton, K.W., James, R.H., Van Calstern, P., Gislason, S.R. and Sigmarsson, O., 2008, The influence of weathering processes on riverine magnesium isotopes in a basaltic terrain. Earth and Planetary Science Letters, 276, 187-197.
[https://doi.org/10.1016/j.epsl.2008.09.020]

-
Pogge von Strandmann, P.A.E., Forshaw, J. and Schmidt, D.N., 2014, Modern and Cenozoic records of seawater magnesium from foraminiferal Mg isotopes. Biogeosciences, 11, 5155-5168.
[https://doi.org/10.5194/bg-11-5155-2014]

-
Pogge von Strandmann, P.A.E., Opfergelt, S., Lai, Y.-J., Sigfusson, B., Gislason, S.R. and Burton, K.W., 2012, Lithium, magnesium and silicon isotope behaviour accompanying weathering in a basaltic soil and pore water profile in Iceland. Earth and Planetary Science Letters, 339, 11-23.
[https://doi.org/10.1016/j.epsl.2012.05.035]

-
Pokrovsky, B.G., Mavromatis, V. and Pokrovsky, O.S., 2011, Co-variation of Mg and C isotopes in late Precambrian carbonates of the Siberian Platform: A new tool for tracing the change in weathering regime? Chemical Geology, 290, 67-74.
[https://doi.org/10.1016/j.chemgeo.2011.08.015]

-
Pokrovsky, O.S., Viers, J., Emnova, E.E., Kompantseva, E.I. and Freydier, R., 2008, Copper isotope fractionation during its interaction with soil and aquatic microorganisms and metal oxy(hydr) oxides: possible structural control. Geochimica et Cosmochimica Acta, 72, 1742-1757.
[https://doi.org/10.1016/j.gca.2008.01.018]

-
Ra, K. and Kitagawa, H., 2007, Magnesium isotope analysis of different chlorophyll forms in marine phytoplankton using multi-collector ICP-MS. Journal of Analytical and Atomic Spectrometry, 22, 817-821.
[https://doi.org/10.1039/b701213f]

-
Ra, K., Kitagawa, H. and Shiraiwa, Y., 2010, Mg isotopes in chlorophyll-a and coccoliths of cultured coccolithophores (Emiliania huxleyi) by MC-ICP-MS. Marine Chemistry, 122, 130-137.
[https://doi.org/10.1016/j.marchem.2010.07.004]

-
Rudnick, R.L. and Gao, S., 2003, Composition of the continental crust. In: Rudnick, R.L. (Ed.) The Crust. Treatise on Geochemistry. Elsevier-Pergamon, Oxford, pp. 1-64.
[https://doi.org/10.1016/B0-08-043751-6/03016-4]

-
Russell, S.S., Huss, G.R., Fahey, A.J., Greenwood, R.C., Hutchison, R. and Wasserburg, G.J., 1998, An isotopic and petrologic study of calcium-aluminum-rich inclusions from CO3 meteorites. Geochimica et Cosmochimica Acta, 62, 689-714.
[https://doi.org/10.1016/S0016-7037(97)00374-8]

-
Ryu, J.-S., Jacobson, A.D., Holmden, C., Lundstrom, C. and Zhang, Z., 2011, The major ion, δ44/40Ca, δ44/42Ca, and δ26/24Mg geochemistry of granite weathering at pH = 1 and T = 25℃: power-law processes and the relative reactivity of minerals. Geochimica et Cosmochimica Acta, 75, 6004-6026.
[https://doi.org/10.1016/j.gca.2011.07.025]

-
Ryu, J.-S., Vigier, N., Decarreau, A., Lee, S.-W., Lee, K.-S., Song, H. and Petit, S., 2016, Experimental investigation of Mg isotope fractionation during mineral dissolution and clay formation. Chemical Geology, 445, 135-145.
[https://doi.org/10.1016/j.chemgeo.2016.02.006]

-
Schauble, E.A., 2004, Applying stable isotope fractionation theory to new systems. Reviews in Mineralogy and Geochemistry, 55, 65-111.
[https://doi.org/10.2138/gsrmg.55.1.65]

-
Schauble, E.A., 2011, First-principles estimates of equilibrium magnesium isotope fractionation in silicate, oxide, carbonate and hexaaquamagnesium(2+) crystals. Geochimica et Cosmochimica Acta, 75, 844-869.
[https://doi.org/10.1016/j.gca.2010.09.044]

-
Schwarcz, H.P., Agyei, E.K. and McMullen, C.C., 1969, Boron isotopic fractionation during clay adsorption from sea-water. Earth and Planetary Science Letters, 6, 1-5.
[https://doi.org/10.1016/0012-821X(69)90084-3]

-
Shannon, R.D., 1976, Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides. Acta Crystallographica, A32, 751-767.
[https://doi.org/10.1107/S0567739476001551]

-
Teng, F.-Z., 2017, Magnesium Isotope Geochemistry. Reviews in Mineralogy and Geochemistry, 82, 218-287.
[https://doi.org/10.2138/rmg.2017.82.7]

-
Teng, F.-Z., Li, W.-Y., Rudnick, R.L. and Gardner, L.R., 2010, Contrasting behavior of lithium and magnesium isotope fractionation during continental weathering. Earth and Planetary Science Letters, 300, 63-71.
[https://doi.org/10.1016/j.epsl.2010.09.036]

-
Tipper, E.T., Calmels, D., Gaillardet, J., Louvat, P., Capmas, F. and Dubacq, B., 2012a, Positive correlation between Li and Mg isotope ratios in the river waters of the Mackenzie Basin challenges the interpretation of apparent isotopic fractionation during weathering. Earth and Planetary Science Letters, 333, 35-45.
[https://doi.org/10.1016/j.epsl.2012.04.023]

-
Tipper, E.T., Gaillardet, J., Louvat, P., Capmas, F. and White, A.F., 2010, Mg isotope constraints on soil pore-fluid chemistry: Evidence from Santa Cruz, California. Geochimica et Cosmochimica Acta, 74, 3883-3896.
[https://doi.org/10.1016/j.gca.2010.04.021]

-
Tipper, E.T., Galy, A. and Bickle, M.J., 2008, Calcium and magnesium isotope systematics in rivers draining the Himalaya-Tibetan-Plateau region: Lithological or fractionation control? Geochimica et Cosmochimica Acta, 72, 1057-1075.
[https://doi.org/10.1016/j.gca.2007.11.029]

-
Tipper, E.T., Galy, A., Gaillardet, J., Bickle, M.J., Elderfield, H. and Carder, E.A., 2006, The magnesium isotope budget of the modern ocean: Constraints from riverine magnesium isotope ratios. Earth and Planetary Science Letters, 250, 241-253.
[https://doi.org/10.1016/j.epsl.2006.07.037]

-
Tipper, E.T., Lemarchand, E., Hindshaw, R.S., Reynolds, B.C. and Bourdon, B., 2012b, Seasonal sensitivity of weathering processes: Hints from magnesium isotopes in a glacial stream. Chemical Geology, 312, 80-92.
[https://doi.org/10.1016/j.chemgeo.2012.04.002]

-
Urey, H.C., 1947, The thermodynamic properties of isotopic substances. Journal of the Chemical Society (London), 562-581.
[https://doi.org/10.1039/jr9470000562]

-
Wimpenny, J., Colla, C.A., Yin, Q.-Z., Rustad, J.R. and Casey, W.H., 2014, Investigating the behaviour of Mg isotopes during the formation of clay minerals. Geochimica et Cosmochimica Acta, 128, 178-194.
[https://doi.org/10.1016/j.gca.2013.12.012]

-
Wimpenny, J., Gislason, S.R., James, R.H., Gannoun, A., Pogge Von Strandmann, P.A.E. and Burton, K.W., 2010, The behaviour of Li and Mg isotopes during primary phase dissolution and secondary mineral formation in basalt. Geochimica et Cosmochimica Acta, 74, 5259-5279.
[https://doi.org/10.1016/j.gca.2010.06.028]

-
Wombacher, F., Eisenhauer, A., Bohn, M., Gussone, N., Regenberg, M., Dullo, W.-C. and Ruggeberg, A., 2011, Magnesium stable isotope fractionation in marine biogenic calcite and aragonite. Geochimica et Cosmochimica Acta, 75, 5797-5818.
[https://doi.org/10.1016/j.gca.2011.07.017]