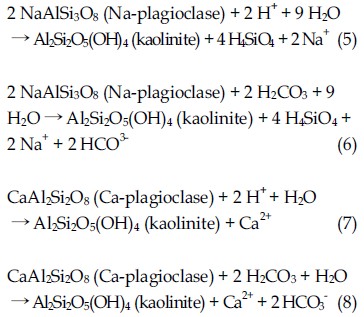The effects of the carbon dioxide stored in geological formations on the mineralogical and geochemical alterations of phyllosilicate minerals
This study aims to identify the geochemical and mineralogical effects of carbon dioxide stored in geological formations on the subsurface environments. A series of autoclave experiments were conducted to simulate the interactions in the CO2-groundwater-phyllosilicate reaction systems using a high pressure and temperature cell at 50℃ and 100 bar. Kaolinite and montmorillonite were used as geological materials reactive in CO2-rich acidic environments, and groundwater samples from a 800 m-depth well were applied as aqueous solutions. The characteristics of dissolution of phyllosilicate minerals and their geochemical and mineralogical alterations after 30-days of reaction were quantitatively examined with XRD, XRF, ICP-OES and SEM/EDX. Throughout the experiments, the dissolution of CO2 resulted in lowering the pH, increasing cation concentrations in the aqueous phase, and, thereby, the changes in composition and interlayer spacing in the mineral phase. The experimental results clearly showed the enhanced dissolution of kaolinite and montmorillonite with the presence of CO2. They also suggested that geochemical processes such as dissolution/precipitation and cation exchange played major roles in physical and chemical changes in pore structure and groundwater in relevant formations and aquifers.
초록
이 연구는 지중저장된 이산화탄소가 심부 지하 환경에 미치는 지질학적 및 광물학적 영향을 규명하기 위하여 수행되었다. 이를 위하여 이산화탄소 지중저장 조건에 해당하는 50℃와 100 bar의 고온·고압조건을 고압셀 내에서 구현하고, 초임계 CO2-지하수-층상규산염광물 시스템 내에서의 반응 실험을 실시하였다. 반응실험에는 층상규산염 광물인 카올리나이트와 몬모릴로나이트 시료를 CO2가 유입되어 조성된 산성 환경에서의 반응광물로 선택하고, 지하 800 m에서 채취된 온천수를 지하수 시료로 사용하였다. 30일간의 반응실험을 통하여 광물 시료의 용해 특성과 반응 전후의 지화학적 및 광물학적 변화를 XRD, XRF, ICP-OES, SEM/EDX 등의 분석을 통해 정량적으로 규명하고자 하였다. 실험을 통하여 이산화탄소의 용해로 조성된 산성 환경에서 야기된 점토광물의 용해가 지하수 내 pH와 양이온 농도의 변화에 영향을 미치고, 광물 시료의 조성뿐만 아니라 층간 간격 등 광물상의 변화를 유도하는 일련의 과정이 관측되었다. 실험의 결과는 이산화탄소의 존재가 카올리나이트와 몬모릴로나이트 시료로 대표된 층상규산염광물의 용해를 촉진할 수 있음을 뚜렷하게 보여주었다. 또한 광물상의 용해/침전과 양이온 교환 등 지화학적 반응들이 지중저장 관련 지층의 암석과 지하수의 물리화학적 변화에 중요한 영향을 미칠 수 있다는 점을 입증하였다.
Keywords:
Carbon dioxide, phyllosilicate minerals, kaolinite, montmorillonite, dissolution, 이산화탄소, 층상규산염광물, 카올리나이트, 몬모릴로나이트, 용해1. 서 론
산업혁명 이후 급증한 화석연료의 사용은 연소 후 발생된 대규모 이산화탄소의 대기 중 방출을 초래하였으며, 이로 인한 대기 중 이산화탄소 농도의 증가는 지구 온난화의 주요한 원인으로 지목되고 있다(IPCC, 2005). 지구 온난화와 세계적인 기후 변화로 야기되는 환경적 재앙을 완화시키기 위하여 다양한 기술적 방안들이 제시되고 있는데, 이 중 이산화탄소 지중저장은 대규모 배출원으로부터 화석연료의 연소 전후에 포집된 이산화탄소를 지하 수 km 깊이의 안정적인 지질 구조 안에 주입하여 반영구적으로 격리시키는 기술이다. 지중저장은 지금까지 제시된 이산화탄소 처리 기술 가운데 가장 경제적이고 현실적인 대안으로 인정받아 미국, EU, 호주, 일본 등 기술선진국을 중심으로 활발한 연구가 진행되고 있다(Bachu, 2000; Akimoto et al., 2004; Emberley et al., 2004). 지중주입된 이산화탄소는 심부대수층의 고온·고압 환경에서 높은 밀도와 낮은 점도를 가진 초임계상으로 상변이한 후 주변 공극의 지하수(또는 염수)를 대체하면서 다양한 포획 기작을 통하여 안정적으로 저장·격리된다(Bachu et al., 1994; Hitchon, 1996; IPCC, 2005). 다공성 저장대상지층 내로 주입된 이산화탄소는 저투과성의 상부 덮개암 등으로 인한 폐쇄적인 지질구조 속에서 상부로의 거동이 제한되어, 저류층의 공극을 따라 거동하거나 공극 사이에 잔류하면서 시간이 경과함에 따라 서서히 주변의 공극수에 용해된다. 이산화탄소의 용해로 조성된 산성 환경은 저류층 또는 덮개암 구성광물의 용해를 촉진하여 지층의 공극 구조에 영향을 미칠 수 있다. 또한 고농도로 용해된 탄산이온은 저장지층을 구성하는 암석의 조암광물들인 금속 산화물이나 규산염 광물과 반응하여 광물화되면서 지층 내 수리지질학적 거동 특성을 변화시킬 수 있다. 따라서 이산화탄소 지중저장의 장기적인 안정성을 평가하기 위해서는 지중주입된 이산화탄소가 암석 입자와 공극수 등 저장 대상 지층의 지질환경과 반응하여 일어나는 다양한 광물학적 및 지화학적 반응에 대한 정확한 이해가 반드시 필요하다(Kwak et al., 2011). 이를 위하여 지난 20여년간 이산화탄소 지중저장 과정에서 일어날 수 있는 다양한 광물학적 또는 지화학적 반응에 관한 연구가 광범위하게 이루어져 왔는데, 특히 지중저장이 수행되는 심부 지층의 온도와 압력 조건 하에서 초임계 CO2(scCO2)-지하수-암석/광물계의 용해 및 침전 반응과 이로 인한 공극률 또는 투과도의 변화에 관한 연구에 많은 관심이 집중되어 왔다(e.g., Montes- Hernandez and Pironon, 2009; Garcia et al., 2010; Kihm et al., 2012; Yoo et al., 2013).
이 연구에서는 이산화탄소 지중저장이 구현되는 심부 지층 내 고온·고압 환경을 모의하는 고압셀 실험을 통하여 초임계 이산화탄소-지하수-점토광물 계에서 발생하는 상호작용을 정량적으로 규명하고자 하였다. 이를 위하여 이산화탄소의 유입과 용해로 조성된 산성 환경이 층상규산염광물인 카올리나이트와 몬모릴로나이트에 미치는 영향에 대한 실내 실험을 수행하고, 반응 후 지하수와 점토광물에서 관측된 지화학적 및 광물학적 변화를 정량화하기 위한 분석을 실시하였다. 본 연구의 결과는 이산화탄소 지중저장이 수행되는 대상 지층 또는 주변 지질구조에서 예상되는 공극 내 미시적인 변화를 이해하는데 도움이 될 수 있을 것으로 판단된다.
2. 실험 재료
이 연구에서는 각각 1:1층 결합구조와 2:1층 결합구조로 이루어진 층상규산염광물인 카올리나이트와 몬모릴로나이트를 실험 대상 점토광물로 선택하였다. 반응 실험에서는 미국 점토광물학회(The Clay Minerals Society)로부터 분말 상태로 구입된 광물 시료로부터 입자 크기와 비표면적이 비교적 균일한 시료를 선별하기 위하여 100번체(지름 150 μm)로 체가름하여 통과한 입자들을 사용하였다. X-선 형광분석(XRF; XRF-1700, Shimadzu)을 이용하여 각 점토광물 시료의 구성 성분을 분석한 결과에 따르면, 실험에 사용된 카올리나이트 시료는 전체 성분 중 SiO2와 Al2O3 비율이 각각 46.05%와 35.74%로 대부분을 차지하고 있으며, 소량의 CaO, Fe2O3, K2O, Na2O, MgO, TiO2 등이 포함된 것으로 나타났다. 또한, 몬모릴로나이트 시료는 SiO2의 비율이 63.99%로 가장 높았으며, 다음으로는 Al2O3, Fe2O3, MgO, Na2O, CaO, K2O 등의 순으로 나타났다. 실험에 사용된 점토광물 시료의 물리적 성질과 화학 조성은 표 1에 나타낸 바와 같다.
시료의 구성광물과 결정 구조를 확인하기 위하여 수행된 X-선 회절분석(XRD; X'Pert-MPD System, Philips; X-선(CuKα, λ= 1.5406 Å), 출력(40 kV, 30 mA), 측정범위(5 ~ 80°(2θ)), 주사속도(4°/min))의 결과에 따르면, 카올리나이트 시료의 회절선은 12.22°, 20.98°, 24.81°에서 나타났으며, 층간거리가 7.23 Å인 [010] 결정면에서 가장 높은 강도를 나타내었다. 또한 회절 패턴의 21.95°, 27.60°, 27.89° 지점에서 사장석의 피크가 확인되었으며, 20.86°, 26.64°, 50.15° 지점에서 나타난 석영의 피크와 8.72°, 33.63°, 26.36° 지점에서 나타난 운모의 피크가 확인되었다. 따라서, 이 카올리나이트 시료는 카올리나이트가 대부분을 차지하고 있으나, 소량의 석영과 사장석, 미량의 운모가 혼재되어 있는 것으로 나타났다. 몬모릴로나이트 시료의 회절선은 6.82°, 20.82°, 23.94°에서 나타났으며, 층간거리 12.95 Å인 [001] 결정면에서 가장 높은 강도를 나타내었다. 또한 회절 패턴의 20.78°, 26.57°, 36.49° 지점에서 석영의 피크가 확인되었다. 따라서 이 몬모릴로나이트 시료 에는 몬모릴로나이트와 소량의 석영이 혼재하는 것으로 나타났는데, 이는 XRF 분석에서 SiO2가 높은 함량을 나타내는 원인인 것으로 판단되었다.
실험에 사용된 지하수는 부산광역시 수영구 광안동에 소재하는 온천정을 통하여 지하 800 m 깊이의 대수층으로부터 채취하였다. 지하수 시료의 초기 pH는 6.93이었으며, 표 2에 나타난 ICP-OES (7000DV, PerkinElmer)와 IC (ICS-1000, Dionex) 분석 결과에 따르면, 실험에 사용된 지하수 시료는 정량 분석된 이온 중 Na와 Cl의 농도가 상대적으로 높은 해수 기원의 지하수로 판명되었다. 다만, NO3- 등이 비교적 높은 농도로 나타나는 점은 이 지하수 시료에 심부와 천부 대수층의 지하수가 혼합되어 있을 개연성을 나타내고 있었다.
3. 실험 방법
이산화탄소 지중저장이 주입된 이산화탄소가 초임계상으로 존재할 수 있는 최소 심도 800 m 이하(육상의 경우)의 심부에서 이루어짐을 고려하여, 반응 실험의 온도와 압력은 이산화탄소의 임계온도(31.1℃)와 임계압력(7.38 MPa) 이상의 50℃와 100 bar (10.0 MPa)로 각각 설정하였다. 심부 지층 내에서의 온도 및 압력 조건을 실험실에서 재현하기 위하여 스테인리스강으로 제작된 100 ml 용량의 고압셀을 이용하였다(그림 1). 테프론으로 코팅된 고압셀 내부에 점토광물 시료 6 g과 지하수 60 ml를 넣고 밀폐한 후, 고압펌프(SFT-10, Supercritical Fluid Technologies)와 역압력조절기(BPR-6000, Hiflux)를 이용하여 액체상 이산화탄소를 주입하고 고압셀 내부 압력을 100 bar로 유지하였다. 또한 발열 재킷(heating jacket, Iwoo Scientific Corp.)으로 고압셀 내부 온도를 사전 설정된 50℃에서 안정화시키면서 주입된 이산화탄소가 초임계상으로 변화할 수 있도록 실험 조건을 유지하였다. 이후 고압셀을 고압펌프로부터 분리하고 내부온도가 50℃로 고정된 오븐에 안치하고 최대 30일간 반응을 유지하였다. 온도 및 압력 조건의 영향을 비교하기 위하여 상온·상압 조건에서 반응을 수행한 대조군은 상온에서 이산화탄소를 포화시킨 지하수에 점토광물 시료를 넣고 밀봉하여 보관하였으며, 이산화탄소의 영향을 비교하기 위한 대조군은 이산화탄소의 주입없이 헬륨을 이용하여 고압셀 내에 동일한 압력조건을 설정한 후 같은 온도 조건에서 함께 오븐에 보관하였다.
정해진 시간만큼의 반응이 끝난 후에는 시료들을 고압셀로부터 회수하고, 이를 원심분리기를 이용하여 지하수 시료와 광물 시료를 분리하였다. 지하수 시료는 pH 측정기(pH/Ion S220, Mettler Toledo)를 이용하여 반응 전후 용액의 pH를 측정하고, ICP-OES를 이용하여 주요 양이온(K, Na, Ca, Mg, Al, Si 등)의 농도를 분석하였다. 원심분리기에 의해 분리된 점토광물은 자연건조 후 XRF, XRD와 SEM-EDS (S-2400, Hitachi)를 이용하여 반응이 진행되는 동안 일어난 광물상 변화를 관찰하였다.
4. 결과 및 토의
4.1 지하수의 지화학적 변화
고온·고압 조건에서 이산화탄소의 용해로 인한 산성 환경에서 점토광물의 용해가 주변 지하수에 미치는 지화학적 변화를 분석하기 위하여 반응시간에 따른 지하수의 pH 변화를 측정하였다. 온도와 압력이 CO2 용해도에 미치는 영향에 대한 Duan and Sun (2003)의 연구 결과에 의하면 1 M의 NaCl 용액에서의 CO2 용해도는 1 bar와 100 bar (20℃)에서 각각 0.03과 0.93 M로, 고압조건하에서 보다 많은 양의 CO2가 지하수에 용해될 수 있다. 반응 전 상온·상압조건에서 pH 6.93의 지하수 시료는 고온·고압 조건에서 scCO2 또는 He과 함께 24시간 정치한 후 pH가 각각 3.98과 6.93으로 측정되었으며, 이를 반응 실험의 초기 pH로 설정하였다. 10일간 scCO2 또는 He를 주입하여 유지된 고온·고압조건에서 카올리나이트 시료와 함께 반응한 지하수의 pH는 각각 4.42와 5.95로 측정되었으며, 몬모릴로나이트와 함께 반응한 지하수의 pH는 각각 6.63과 7.76으로 측정되었다. 이후 반응 기간 동안 각 지하수 시료의 pH는 비교적 일정하게 유지되었다(그림 2).
pH change in the groundwater reacted with mineral samples (kaolinite: circle ; montmorillonite: square) in systems with scCO2 (solid symbols) and with He (without scCO2) (open symbols).
산성, 중성 및 염기성 환경에서 규산염광물 표면에서의 풍화를 일으키는 물질은 각각 H+, H2O, OH-이다(Huertas et al., 1999). CO2가 포함된 지하수-점토광물 반응 실험에서는 주입된 CO2가 지하수에 빠르게 용해되면서 반응 초기 pH 4 내외의 산성 환경이 조성된다. 이후 시간이 경과함에 따라 지하수에 용존하는 H+가 소모되고, 층상규산염광물인 두 광물시료의 표면으로부터 가수분해로 인한 용해가 일어나 염기성 양이온들이 용출됨으로써 산중화(acid neutralisation)에 의한 pH 증가가 나타난다. 다음은 이 실험의 pH 조건에서 CO2의 포함 여부에 따른 카올리나이트와 몬모릴로나이트 용해반응식을 정리한 것이다.
그림 2에 나타난 바와 같이 반응 기간 동안 나타나는 전반적인 pH의 증가는 카올리나이트 시료에 비하여 몬모릴로나이트 시료에서 더 현저하게 나타나는데, 이는 두 시료의 용해반응 기작의 차이에 기인한다. 식 (1)과 (2)에 나타난 바와 같이 pH 4∼8의 실험 조건에서 카올리나이트의 용해로 생성된 Al은 자유상의 이온으로 존재하기 보다는 불일치 용해(incongruent dissolution)를 통하여 깁사이트 등 다른 형태의 알루미노규산염 광물로 재침전된다. 이러한 과정에서 H+의 생성이나 소모는 발생하지 않으며, 산성 조건에서 상대적으로 안정적인 규산을 생성한다. 이에 비하여 몬모릴로나이트의 가수분해(식 (3)과 (4))로 용출된 Al은 카올리나이트 등 알루미노규산염 광물로 재침전되면서 수소 이온을 소모함과 동시에 Na와 Mg 등 염기성 양이온을 방출한다. 이를 통하여 카올리나이트 시료와 반응한 지하수에 비하여 몬모릴로나이트 시료와 반응한 지하수에서 pH가 훨씬 빠르게 증가한 것으로 나타났다.
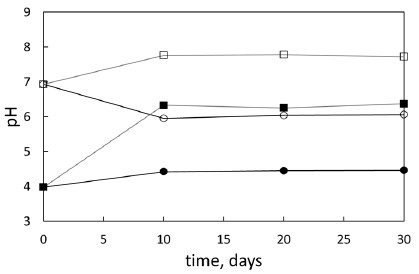
고온·고압 조건에서 scCO2-지하수-점토광물 반응이 진행되는 동안 지하수 내 용존 양이온의 농도 변화를 정성적 및 정량적으로 규명하기 위하여 주요 양이온에 대한 ICP-OES 분석을 수행하고, 반응 기간에 따른 분석 결과를 그림 3와 4에 나타내었다. 분석을 통해 측정된 지하수의 용존 이온 농도 변화에 따르면, 카올리나이트 시료에 대한 반응 실험의 경우, He 또는 scCO2와 반응한 지하수 시료 모두에서 초기 지하수의 용존 이온 농도에 비하여 Na, Mg, Si의 농도는 증가한 반면, Ca와 Al은 유의미한 차이를 나타내지 않았다(그림 3). 이러한 지하수 내 양이온 농도의 전반적인 증가 경향은 카올리나이트와 사장석의 용해에 의한 것으로, 특히, 카올리나이트에 비하여 용해에 취약한 사장석의 영향이 크게 작용한 것으로 판단된다. 따라서 그림 3a에 나타난 바와 같이 scCO2와 반응한 경우에서 Na 농도의 증가가 가장 뚜렷하게 나타나는 것은 scCO2의 용해로 조성된 지하수 내 산성 환경에서 사장석의 용해반응이 상대적으로 더욱 촉진되었기 때문으로 판단된다. 또한, pH 4 이상의 조건에서의 카올리나이트 용해반응에서 Al과 Si가 비화학양론적(non-stoichiometric) 농도분포를 나타내며 Si에 비하여 Al가 매우 낮은 농도로 검출되는 것은 식 (1)과 (2)에 나타난 바와 같은 Al의 재침전이 원인으로 보고되고 있다(Rozalen et al., 2008; Khawmee et al., 2013).
The concentrations of the dissolved components in the groundwater samples as a function of time during the reaction with the kaolinite sample (a) Na and Ca (b) Mg, Si, and Al (with scCO2 : solid symbols; with He : open symbols).
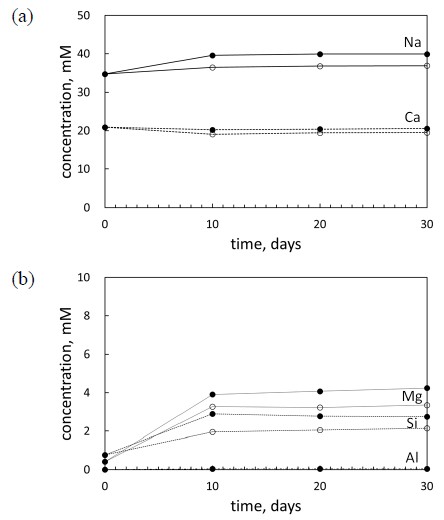
The concentrations of the dissolved components in the groundwater samples as a function of time during the reaction with montmorillonite sample (a) Na and Ca (b) Mg, Si, and Al (with scCO2 : solid symbols; with He : open symbols).
몬모릴로나이트 시료에 대한 ICP-OES 분석 결과에 따르면 지하수 내 양이온 농도는 반응전과 비교하여 Na, Mg, Si의 농도는 증가하고, Ca의 농도는 감소하는 것으로 나타났다(그림 4). 또한 He와 반응한 지하수에 비하여 scCO2와 반응한 지하수에서의 용존 이온 농도가 전반적으로 높게 나타났는데, 이 역시 산성 환경 내에서 촉진된 몬모릴로나이트 용해 반응의 영향으로 해석될 수 있다. 특히, 용존 이온 변화 중 Na의 증가와 Ca의 감소가 교차적으로 나타나는 현상은 2:1 규산염광물인 몬모릴로나이트의 양이온 교환 반응에 의하여 결합 층간에 존재하는 Na가 지하수 내 용존 Ca에 의해 치환되었기 때문으로 판단된다.
지하수의 pH 변화와 마찬가지로 양이온 농도의 변화 역시 반응 초기 10일까지 대부분의 변화가 나타나고, 10일 이후 뚜렷한 변화가 나타나지 않는 것은 이 연구에서 수행된 반응 실험이 실험 재료와 조건에 차이없이 10일 이내에 겉보기 평형상태에 도달했음을 의미한다.
4.2 점토광물의 광물학적 변화
고온·고압 조건에서 scCO2-지하수-점토광물계 내에서 점토광물에 나타나는 광물학적 및 지화학적 변화를 규명하기 위하여 XRF 및 XRD 분석을 수행하였다. 점토광물 시료의 구성 성분 분석을 위한 XRF 분석은 30일 반응 실험 이후 시료에 대하여 실시하였고, 분석 결과는 표 3에 나타낸 바와 같다.
XRF 분석 결과 고온·고압 조건에서 반응 실험을 실시한 카올리나이트 시료의 구성 성분은 반응 전 시료와 비교하였을 때 이산화탄소의 포함 여부와 관계없이 유의미한 차이를 나타내지 않았다. 이에 반하여 몬모릴로나이트 시료의 경우는 반응 전과 비교하면 CaO는 He가 포함된 반응에서 115.1%, scCO2가 포함된 반응에서 122.3% 증가하고, Na2O와 MgO는 He가 포함된 반응에서 각각 29.6%와 33.8%, scCO2가 포함된 반응에서 각각 17.6%와 21.2% 감소한 것으로 분석되었다. 이러한 함량의 증감 변화는 몬모릴로나이트의 층간에 존재하는 Na가 지하수에 용존하는 Ca와 교체되는 양이온 교환에 의하여 시료 내 Na가 감소하고 Ca가 증가했기 때문으로 판단된다.
고온·고압 조건에서 30일 동안 지하수 및 scCO2와 반응한 카올리나이트와 몬모릴로나이트 시료에 대해 수행된 XRD 분석의 결과를 각각 그림 5와 6, 표 4에 나타내었다. 분석의 결과에서는 반응 전 시료의 광물 구성과 비교하여 반응에 의해 새롭게 형성된 이차광물에 의한 뚜렷한 피크는 발견되지 않았다. 그러나 ICP- OES 결과 분석에서 나타난 지하수 내 용존 Si/Al 농도 분포에서 암시된 알루미늄 광물로 재침전 가능성에도 불구하고, 반응 후 고형물에 대한 XRD 분석에서 새로운 이차 광물의 피크가 발견되지 않은 것은 이 침전물이 분석에 나타나기 어려울 정도의 미량이거나 비정질 상태로 형성되었기 때문으로 추측된다.
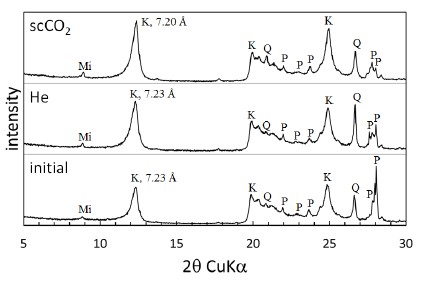
X-ray diffraction profiles of the kaolinite sample before and after the reaction experiment at 50℃ and 100 bar (K: kaolinite, P: plagioclase, Q: quartz, Mi: mica).
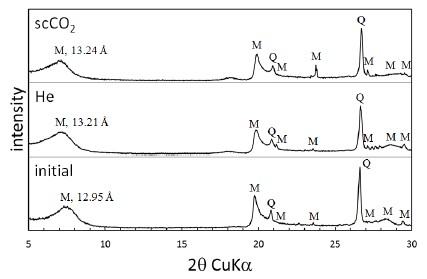
X-ray diffraction profiles of the montmorillonite sample before and after the reaction experiments at 5 0℃ and 100 bar (M: montmorillonite, Q: quartz).

X-ray diffractional characteristics of the mineral samples used in the experiments at 50℃ and 100 bar.
이에 반하여 구성광물의 함량과 결정구조의 변화를 유추할 수 있는 기존 XRD 피크의 강도 변화는 다소의 유의미한 변화를 보여주었다. 카올리나이트 시료의 반응 전후 XRD 피크의 강도를 비교하면(그림 5), 반응 이후 전반적으로 카올리나이트 피크의 강도는 증가하고, 사장석의 강도는 감소하는 것으로 나타났다. 이러한 변화는 카올리나이트와 사장석의 상대적 구성비의 변화를 의미하는 것으로, 시료에 포함된 사장석이 가수분해되어 카올리나이트가 추가적으로 형성되었거나, 또는 산성 환경에서의 용해에 상대적으로 안정적인 광물인 카올리나이트에 비하여 사장석이 상대적으로 더 큰 비율로 용해되므로써 결정형 광물의 총량 중에서 카올리나이트가 차지하는 구성비가 오히려 증가하여 나타날 수 있다. 그러나 XRD 패턴을 이용한 정량적 분석이 갖는 정밀도를 고려할 때 보다 정확한 정량적 분석을 위해서는 추가의 분석이 필요할 것으로 판단된다. 사장석의 가수분해로 인한 카올리나이트의 형성은 Hangx and Spiers (2009)에 의해 고온·고압조건에서 수행된 scCO2-H2O-사장석 반응실험의 결과와 일치하는 것으로, 다음은 CO2의 포함 여부에 따른 Na-사장석과 Ca-사장석의 용해반응식을 정리한 것이다.
그림 6에 나타난 몬모릴로나이트 시료의 반응 전후 XRD 패턴은 반응 이후 몬모릴로나이트 피크의 강도는 감소하고 석영 피크의 강도는 증가하는 변화를 비교적 뚜렷하게 보여준다. 그러나 석영의 경우, 이 실험에서 이루어지는 지화학적 반응에 의하여 이차광물로서 추가로 생성되거나 용해로 인한 함량의 감소가 예상되지 않으며, X-선 피크의 강도가 구성 광물의 함량에 대한 상대적 크기로 해석될 수 있는 XRD 패턴 분석의 속성을 고려할 때, 이러한 변화는 지하수 내에서의 용해로 인하여 몬모릴로나이트의 구성 함량비가 감소하였기 때문으로 판단된다.
XRD 분석에서 나타난 반응전후 카올리나이트의 층간거리(7.20∼7.23 Å)는 이전 연구에서 보고된 카올리나이트의 일반적인 층간거리 7.2 Å와 유사한 값으로(Sparks, 2002), 반응 실험에 의한 유의미한 변화는 나타나지 않았다. 이는 카올리나이트의 층간 결합이 전기적으로 중성 상태를 이루고 있기 때문에 결합 층간에 존재하는 양이온의 이동이나 치환이 일어나지 않기 때문으로 판단된다. 이에 반하여, 반응 전 12.95 Å이던 몬모릴로나이트의 층간거리는 고온·고압 조건에서 He 또는 scCO2가 포함된 지하수와의 반응 이후 각각 13.21 Å과 13.24 Å로 2.0∼2.2% 확대된 것으로 나타났다(표 4). 이러한 몬모릴로나이트 층간거리의 변화는 2:1 결정구조의 층간에 존재하는 교환성 양이온이 이온 반경이 더 큰 용존 양이온과 치환되거나 물분자가 층간에 삽입되어 일어날 수 있다. 또한 고압 조건에서 층상형 광물이 CO2와 반응하는 경우 광물 입자의 수화 정도에 따라 CO2 분자가 층간에 삽입되어 입자의 팽창을 야기할 수 있다 (Giesting et al., 2012, Loring et al., 2013, Romanov, 2013). 이 실험의 경우, XRF 분석결과에서는 반응 후 몬모릴로나이트 시료에서의 CaO 비율은 증가하고 NaO 비율은 감소한 것으로 나타났으며, ICP-OES 분석에서는 지하수 내 Ca의 농도가 감소하고 Na의 농도가 증가한 것으로 나타난 점을 고려하면, 몬모릴로나이트 층간의 Na와 지하수에 용존하는 Ca 사이에 양이온 교환이 일어난 것으로 짐작할 수 있다. 그러나 원래 몬모릴로나이트의 층간에 존재하던 Na에 비하여 새롭게 삽입된 Ca의 이온 반경이 오히려 다소 작은 점을 고려하면, 이 과정에서 몬모릴로나이트의 층간에서 Na/Ca의 양이온 교환과 함께 물분자와 CO2 분자의 삽입이 일어났을 것으로 추측된다. 이러한 입자 규모의 층간 간격 변화는 팽창성 점토광물이 포함된 지질 구조에 대규모의 이산화탄소가 유입되는 경우 공극의 크기와 투과도에 변화를 야기함으로써 이산화탄소 지중저장 과정에서 주입 대상 지층의 저장 효율이나 덮개암층의 차폐능에 영향을 미칠 수 있을 것으로 판단된다.
5. 결 론
이 연구는 지중저장된 이산화탄소로 인해 심부 지질구조 내에 조성된 산성 환경에서 발생되는 scCO2- 지하수-점토광물 간 지화학적 반응을 규명하기 위해 수행되었다. 이를 위하여 층상규산염 광물인 카올리나이트와 몬모릴로나이트 시료를 대상으로 50℃와 100 bar의 조건에서 30일간의 고온·고압실험을 수행하고, 반응 전후 점토광물 및 지하수 시료에 대한 XRF, XRD, ICP-OES 분석을 실시하여 반응에 따른 지화학적 및 광물학적 변화를 정량적으로 파악하였다. 이 실험적 연구의 결론은 다음과 같다.
scCO2의 용해로 조성된 산성 환경에서 30일간 반응한 카올리나이트와 몬모릴로나이트 시료에는 H+의 흡착과 가수분해로 인한 용해가 진행되어 지하수 내 용존 양이온(Na, Mg, Si 등)의 농도가 증가함으로써, 반응이 경과함에 따라 반응 전 3.96이었던 지하수의 pH는 반응 10일 이후 4.42(카올리나이트)와 6.63(몬트모릴로나이트)로 증가하는 산중화가 나타났다.
• 카올리나이트와 몬모릴로나이트 시료의 용해로 인해 지하수로 용출된 Al은 알루미노규산염 광물로 재침전됨으로써 층상규산염 광물의 주요 구성원소인 Al과 Si 중에서 Al의 용존농도가 Si에 비하여 현저하게 낮은 농도로 검출되는 비화학양론적 농도분포가 나타났다.
• 30일간의 scCO2-지하수-층상규산염 광물 반응 실험의 결과, 카올리나이트와 몬모릴로나이트 시료의 구성광물 함량비에는 용해로 인한 미세한 변화가 나타났지만, 추가적인 이차광물의 형성은 확인되지 않았다. 이는 압력, 온도, 기간 등 실험조건이 이차광물이 형성되기에 충분하지 않았거나, 이차광물이 생성되었다 하더라도 극히 소량 또는 비정질의 상태로 생성되었기 때문으로 추측되며, 이론적으로 예상되는 이차광물의 형성을 확인하기 위해서는 추가의 분석이 필요한 것으로 판단되었다.
• 반응 전후의 XRD 피크 패턴에 대한 비교에 따르면, 1:1층 결합 광물인 카올리나이트에서는 유의미한 변화를 나타내지 않은데 반하여, 2:1층 결합 광물인 몬모릴로나이트에서는 층간 간격의 증가로 해석될 수 있는 피크의 이동이 발견되었다. 이는 몬모릴로나이트의 결정 층간에 존재하는 Na가 지하수 내 용존 Ca 사이에 발생한 양이온 교환과 몬모릴로나이트 결정 층간으로의 물분자와 CO2 분자의 삽입이 함께 일어난 결과로 판단된다.
연구의 결과는 심부 지질구조 내로 주입된 이산화탄소가 주변 지하수와 암석의 지화학적 및 광물학적 변화에 영향을 미칠 수 있음을 보여주었다. 이를 통하여 이산화탄소 지중저장의 효율성과 안정성을 평가하는데 있어서 저장 대상 지층을 구성하는 암석과 지하수가 이산화탄소와 반응하여 발생하는 다양한 변화에 대한 연구가 반드시 필요함을 시사하고 있다.
Acknowledgments
이 논문은 2013년도 정부(미래창조과학부)의 재원으로 (재)한국이산화탄소포집 및 처리연구개발센터의 지원을 받아 수행된 연구임(NRF-2013M1A8A1035830). 또한 세심한 심사의견으로 이 논문에 많은 도움을 주신 심사자들께 진심으로 감사드립니다.
References
-
K Akimoto, H Kotsubo, T Asami, X Li, M Uno, T Tomoda, T Ohsumi, Evaluation of carbon dioxide sequestration in Japan with a mathematical model, Energy, (2004), 29, p1537-1549.
[https://doi.org/10.1016/j.energy.2004.03.058]

-
S Bachu, Sequestration of CO2 in geological media: criteria and approach for site selection in response of climate change, Energy Conversion and Management, (2000), 41, p953-970.
[https://doi.org/10.1016/S0196-8904(99)00149-1]

-
S Bachu, W.D Gunter, E.H Perkins, Aquifer disposal of CO2: hydrodynamic and mineral trapping, Energy Conversion and Management, (1994), 35, p269-279.
[https://doi.org/10.1016/0196-8904(94)90060-4]

- Z Duan, R Sun, An improved model calculating CO2 solubility in pure water and aqueous NaCl solutions from 257 to 533 K and from 0 to 2000 bar, Chemical Geology, (2003), 193, p257-271.
-
S Emberley, I Hutcheon, M Shevalier, K Durocher, W.D Gunter, E.H Perkins, Geochemical monitoring of fluid-rock interaction at CO2 storage at the Weyburn CO2-injection enhanced oil recovery site, Saskatchewan, Canada, Energy, (2004), 29, p1393-1401.
[https://doi.org/10.1016/j.energy.2004.03.073]

-
B Garcia, V Beaumont, E Perfetti, V Rouchon, D Blanchet, P Oger, G Dromart, A.Y Huc, F Haeseler, Experiments and geochemical modelling of CO2 sequestration by olivine: Potential, quantification, Applied Geochemistry, (2010), 25, p1383-1396.
[https://doi.org/10.1016/j.apgeochem.2010.06.009]

- P Giesting, S Guggenheim, A.F Koster van Groos, A Busch, X-ray diffraction study of K- and Ca-exchanged montmorillonites in CO2 atmospheres, Environmental Science & Technology, (2012), 46, p5623-5630.
-
S.J.T Hangx, C.J Spiers, Reaction of plagioclase feldspars with CO2 under hydrothermal conditions, Chemical Geology, (2009), 265, p88-98.
[https://doi.org/10.1016/j.chemgeo.2008.12.005]

- B Hitchon, Aquifer Disposal of Carbon Dioxide: Hydrodynamic and Mineral Trapping – Proof of Concept, Geoscience Publishing Limited, Sherwood Park, (1996), p165.
-
F.J Huertas, L Chou, R Wollast, Mechanism of kaolinite dissolution at room temperature and pressure Part II: Kinetic study, Geochimica et Cosmochimica Acta, (1999), 63, p3261-3275.
[https://doi.org/10.1016/S0016-7037(99)00249-5]

- IPCC, IPCC Special Report on Carbon Dioxide Capture and Storage. Prepared by Working Group III of the Intergovernmental Panel on Climate Change [Metz, B., O. Davidson, H.C. de Coninck, M. Loos, and L.A. Meyer (eds.)]. Cambridge University Press, Cambridge, United Kingdom and NewYork, NY, USA, (2005), p442.
-
K Khawmee, A Suddhiprakarn, I Kheoruenromne, I Bibi, B Singh, Dissolution behaviour of soil kaolinites in acidic solutions, Clay Minerals, (2013), 48, p447-461.
[https://doi.org/10.1180/claymin.2013.048.3.02]

-
J Kihm, J Kim, S Wang, T Xu, Hydrogeochemical numerical simulation of impacts of mineralogical compositions and convective fluid flow on trapping mechanisms and efficiency of carbon dioxide injected into deep saline sandstone aquifers, Journal of Geophysical Research, 117, B06204, (2012).
[https://doi.org/10.1029/2011JB008906]

-
J.H Kwak, J.Z Hu, R.V.F Turcu, K.M Rosso, E.S Ilton, C Wang, J.A Sears, M.H Engelhard, A.R Felmy, D.W Hoyt, The role of H2O in the carbonation of forsterite in supercritical CO2, International Journal of Greenhouse Gas Control, (2011), 5, p1081-1092.
[https://doi.org/10.1016/j.ijggc.2011.05.013]

-
J.S Loring, H.T Schaef, C.J Thompson, R.V Turcu, Q.R Miller, J Chen, J Hu, D.W Hoyt, P.F Martin, E.S Ilton, A.R Felmy, K.M Rosso, Clay hydration/dehydration in dry to water-saturated supercritical CO2: Implications for caprock integrity, Energy Procedia, (2013), 37, p5443-5448.
[https://doi.org/10.1016/j.egypro.2013.06.463]

- G Montes-Hernandez, J Pironon, Hematite and iron carbonate precipitation-coexistence at the iron-montmorillonite-salt solution-CO2 interfaces under high gas pressure at 150℃, Applied Clay Science, (2009), 45, p194-200.
-
V.N Romanov, Evidence of irreversible CO2 intercalation in montmorillonite, International Journal of Greenhouse Gas Control, (2013), 14, p220-226.
[https://doi.org/10.1016/j.ijggc.2013.01.022]

- M Rozalen, F.J Huertas, P.V Brady, J Cama, S Garcia-Palma, J Linares, Experimental study of the effect of pH on the kinetics of montmorillonite dissolution at 25℃, Geochimica et Cosmochimica Acta, (2008), p4224-4253.
- D.L Sparks, Environmental Soil Chemistry, Academic Press, San Diego, (2002), p352.
-
S Yoo, Y Mito, A Ueda, T Matsuok, Geochemical clogging in fracture and porous rock for CO2 mineral trapping, Energy Procedia, (2013), 37, p5612-5619.
[https://doi.org/10.1016/j.egypro.2013.06.483]