슈베르트마나이트의 용해도: 고용체 모델의 적용 가능성
초록
슈베르트마나이트는 Fe8O8(OH)8-2x(SO4)x·nH2O의 화학식을 갖는 제이철산화수산화황산염 광물로 알려져 있다. 슈베르트마나이트의 용해도는 지표 부근의 수지구환경에서 오염물을 포함한 용존 화학종의 행동 해석 및 예측을 위해서는 반드시 필요하다. 그러나 지금까지 연구자들마다 보고하는 슈베르트마나이트의 용해도 값에 상당한 차이가 있어 논란이 지속되어 왔다. 이 연구의 목적은 그 동안 보고된 슈베르트마나이트의 용해도 값들을 정리하고, 이 값들 사이에 차이가 나는 이유들을 살펴보며, 이 차이가 고용체 모델을 통해 해석할 수 있는지 알아보는 것이다. 슈베르트마나이트의 용해도 값의 차이는 용액의 슈베르트마나이트에 대한 포화 정도, 시료 채취시의 여과에 의한 영향, 용해도 계산에 사용된 열역학 자료의 차이, 슈베르트마나이트의 준안정성 및 시료의 순도, 슈베르트마나이트의 화학 조성의 차이 등 때문일 수 있는데, 이 중 가장 큰 원인은 화학 조성의 차이일 것으로 생각된다. 슈베르트마나이트의 화학조성이 일정 범위 내에서 연속적으로 변하는 것은 이 광물이 고용체라는 뜻이며, 그 용해도 또한 고용체를 구성하는 단성분의 비율에 따라 달라져야 함을 의미한다. 이 연구에서는 슈베르트마나이트 고용체를 구성하는 단성분 조합 두 가지를 살펴보았다. 어떤 경우의 단성분 조합이던, 이들 단성분에 대한 정확한 열역학적 자료가 부족하여 적절한 열역학적 모델에 따른 단성분 비율의 함수인 용해도를 계산하는 것은 현재로서는 불가능하다. 다만, 그동안 보고된 용해도 값을 x 값에 따라 도시하면 분명한 상관성을 보여, 고용체모델을 이용하여 슈베르트마나이트의 용해도를 예측하는 것이 가능할 것으로 보이나 이에 대한 좀 더 깊은 연구가 필요하다. 한편 슈베르트마나이트의 화학식으로부터 Fe와 S의 몰 수를 계산한 것과 실제 시료로부터 분석된 몰 수를 비교하면, 슈베르트마나이트가 단일 고용체가 아니라 여러 상들의 혼합체임을 나타낸다. 이는 단순 화학식에 의한 몰비 비교로부터 추론한 것이며, 아직 연구자들 사이에서는 슈베르트마나이트가 정말 고용체인가 하는 점에 대해서는 의견이 일치하지 않고 있다. 따라서 이 점에 대해서도 좀 더 심도 있는 연구가 진행될 수 있길 기대한다.
Abstract
Schwertmannite has been known to be a ferric oxyhydroxysulfate mineral, having the chemical formula of Fe8O8(OH)8-2x(SO4)x·nH2O. The solubility of schwertmannite is absolutely necessary for the interpretation and prediction of the behavior of the dissolved species, including the pollutants, in the aqueous geochemical systems near surface. However, there has been dispute on the solubility of schwertmannite, because the reported solubility values of the mineral have shown considerable discrepancies among the researchers. The purpose of this study is to summarize the solubility values of schwertmannite reported by numerous researchers, discuss the plausible reasons for the discrepancies among the reported values, and check the possibility of interpreting the discrepancies with a solid solution model. The solubility discrepancies can be caused by the differences in the saturation degrees of the solution against schwertmannite, the filtration effects during the sampling, the different thermodynamic data set used in the calculation, the metastability and impurities of the sample, and the chemical compositional difference. The most significant factor among these should be the chemical compositional difference among the samples. The continuous chemical compositional variation of schwertmannite within a certain range suggests that the mineral is a solid solution, and thus its solubility should vary as a function of the mole fractions of the end members of the solution. This study examined two different possible combinations of the end members of the schwertmannite solid solution. At present, the thermodynamic data for the end members of any combination are insufficient and it is impossible to calculate the solubility as a function of the mole fractions of the end members based on an appropriate model. However, the solid solution model to estimate the solubility of schwertmannite may be still promising and need more investigation, because the plot of the reported solubilities against x values certainly shows a correlation. Meanwhile, the comparison of the mole numbers of Fe and S calculated from the chemical formula of schwertmannite with those from the analytical results of the real samples indicates that schwertmannite is not a single solid solution but a mixture of various phases. It is deduced from a simple comparison of chemistry, while many researchers are still arguing whether the mineral is really a single solution phase, which may suggest that more detailed research on this subject is also required.
Keywords:
Schwertmannite, solubilities, solid solution, various phases mixture키워드:
슈베르트마나이트, 용해도, 고용체, 여러상의 혼합체1. 서 론
슈베르트마나이트(schwertmannite; Swm)은 제이철산화수산화황산염(ferric oxyhydroxysulfate) 광물이다. 이 광물의 화학식은 이상적으로는 Fe8O8(OH)6SO4로 표시하지만, SO4의 함량이 일정 범위 내에서 변하고, 약간의 결정수가 존재하고 있어서 일반적으로는 Fe8O8(OH)8-x(SO4)x·nH2O로 표시한다(Yu et al., 1999). 지금까지 보고된 Swm의 화학식에 따르면 0.75≤ x ≤2.58 and 5≤ n ≤9 의 값을 갖는다(Caraballo et al., 2013).
Swm은 독일의 토양학자 우도 슈베르트만(Udo Schwertmann; 1927-2016)의 이름을 따서 지은 광물로 “신종광물 및 광물명 위원회(Commision on New Minerals and Mineral Names)”에 의해 1992년에 정식 광물로 인정받았다. 이 광물은 낮은 결정도로 인해 과거 가끔 비정질 철 화합물로 오인되었지만(Yu, 1996), 사실은 사방정계에 속하는 광물이다. Swm의 결정은 P4/m의 공간군을 가지며, 단위포 크기는 a=10.66 Å 및 6.04 Å, 단위포 함량은 1, 밀도는 3.77~3.99 g/cm3이다(Bigham et al., 1994).
Swm은 황화광물이 풍화되는 산성의 황산 이온이 풍부한 환경에서 Fe(II)가 산화되면서 만들어진다(Bigham et al., 1996) 산성 광산 배수(acid mine darinage, AMD), 산성 호수 및 산성 토양수 등에서 Swm이 쉽게 관찰되는데, 이는 이들 수용액이 해당 광물의 생성 조건을 잘 만족시킬 수 있기 때문이다(Yu et al., 1999). 이렇게 만들어진 Swm은 준안정한 상태로 존재하며, 나중에는 결국 안정한 레피도크로사이트(lepidocrosite)나 침철석(goethite)로 전이하게 된다(Fernández-Martínez et al., 2010).
이와 같은 Swm의 생성과 전이는 지표 부근의 수지구환경에서 일어나므로, 오염물을 포함한 용존 화학종의 행동에 중요한 역할을 미치게 된다(Regenspurg, 2002). 따라서 이러한 화학종들의 행동 해석 및 예측을 위해서는, 이들 화학종을 포함하는 시스템 내에서의 Swm의 안정성 또는 용해도를 정확히 평가할 수 있어야 한다. 그러나 불행하게도. 다른 낮은 결정도의 지표 생성 광물들과 마찬가지로, 연구자들마다 보고하는 Swm의 용해도 값에 차이가 있는 상황이다(e.g., Bigham et al., 1996; Yu et al., 1999; Kawano and Tomita, 2001).
이 연구의 목적은 그 동안 발표된 Swm의 용해도 값을 살펴보고, 이 값들의 불일치 원인들에 대해 토론한 후, 이의 개선을 위해 어떠한 접근이 필요한지를 제안하는 것이다. 특히, 이 제안 중의 하나로 Swm의 용해도를 고용체 모델을 통해서 해석하는 방법에 대해 좀 더 자세히 토론해 보고자 한다.
2. 용해도의 평가
지금까지 문헌에 발표된 Swm의 용해도를 정하는 방법은 크게 용존 화학종의 활동도(activity)로부터 계산하는 방법과 열역학적인 모델로부터 계산하는 방법 두 가지가 있다.
용존 성분의 활동도로부터 용해도를 계산하는 방법은 하나의 용해 반응을 상정하고 그 반응에 따라 평형상수식을 만든 다음, 이 식을 구성하는 용존 성분들의 활동도를 대입하여 계산하는 방식이다. 용존 성분의 활동도는 용존 성분들의 농도를 분석한 후 이 자료를 바탕으로 평형 모델링을 하여 종분화 및 각 종의 활동도를 계산함으로써 얻을 수 있다. 평형 모델링은 보통 소프트웨어 프로그램을 이용하는데, 대표적으로는 PHREEQC (Parkhurst and Appelo, 2013) 및 WATEQ4F (Ball and Nordstrom, 1991) 같은 것이 있다. 하나의 광물에 대한 용해 반응은 여러 방식으로 표현할 수 있는데, 이론적으로는 어떤 식으로 용해 반응을 표현하든 용해 반응이 타당하기만 하다면 광물의 용해도를 측정하는데 아무런 문제가 되지 않는다.
가장 흔히 표현되는 Swm의 용해 반응은 다음과 같다.
| (R1) |
반응(R1)에 대한 평형 상수식은
| (1) |
와 같으며, 여기서 pA=-log10[A]를 의미한다. 이때 [A]는 용존 성분 A의 활동도이다. Swm과 용액이 평형을 이룬 상태에서 측정한 용존 성분의 농도로부터 활동도를 계산할 수 있다면, 식(1)을 이용하여 pKsp 값을 구할 수 있다. 예를 들면, 그림 1과 같이 pFe와 pH를 도시하여 직선을 찾아내고, 이 직선의 절편값 k는
| (2) |
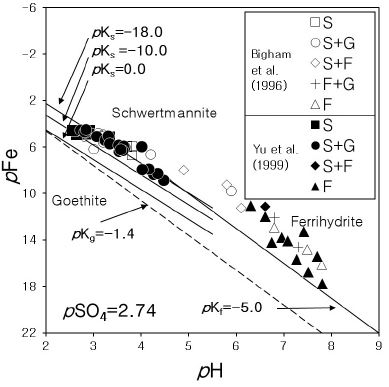
Plot of pFe versus pH values of some acid mine drainage waters. Data from Yu et al. (1999). In the symbol explanation box, S, G, and F represent schwertmannite, goethite, and ferrihydrite, respectively.
로 주어지므로, pSO4 값을 알기만 하면 k 값으로부터 pKsp 즉, 용해도 값을 알 수 있다. 문제는 각 시료마다 pSO4 값이 일정치를 않아 pKsp 값을 정하기 위해서는 시료들이 하나의 pSO4 값을 갖는 것처럼 가정하여야 한다는 점이다. 그림 1에서도 pSO4 값이 2.74로 고정되어 있는 것으로 가정하여 도시하였는데, 실제로 각 시료의 pSO4 값은 이와 상당히 다르며, 이로 인해 Swm의 용해도를 계산하는데 오류가 있을 수 있다. 지금까지 보고된 Swm의 용해도는 대부분 반응(R1)을 바탕으로 한 식(2)에 의해 추정된 것들이다.
위와 같은 용존 황산 이온 농도 변화에 따른 불확실성을 없애고자 표현된 Swm의 용해 반응은 아래와 같다.
| (R1) |
| (R2) |
| (R3) |
위 용해 반응(R3) 기존의 용해 반응(R1)에 물의 해리 반응(R2)를 결합한 것으로, 이 반응의 평형상수를 K’이라 할 때 이는 다음 식과 같이 나타낼 수 있다:
| (3) |
만일 수용액이 Swm와 평형을 이룬다면, 그림 2와 같이 수용액으로부터 측정된 (pFe + 3pOH) 값을 세로축에 따라 그리고 (pSO4 + 2pH) 값을 가로축에 따라 도시하면 직선을 이루어야 하며, 그 직선의 절편 k’은
| (4) |
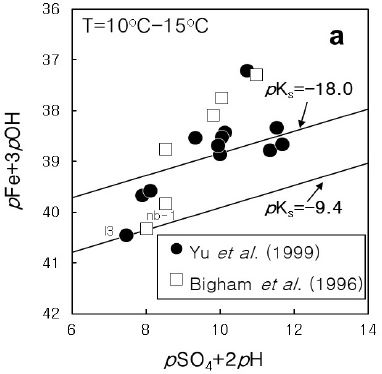
Plot of (pFe + 3pOH) versus (pSO4 + 2pH) of some acid mine drainage waters. Data from Yu et al. (1999).
이 되며, 이로부터 pKsp 값을 얻을 수 있다. 식(4)에서 알 수 있듯이, 주어진 온도에서 물의 해리 상수 Kw 값은 일정하므로 일정한 pSO4 값을 가정할 필요 없이 바로 절편 값으로부터 pKsp 값을 계산할 수 있다. Yu et al. (1999, 2002)는 이 방법을 이용하여 Swm의 용해도를 보고하였다.
열역학적인 모델로부터 계산하는 방법은 Swm의 깁스자유에너지(Gibbs free energy)를 먼저 계산하고 이로부터 용해도를 평가하는 것이다. 주어진 절대 온도 T에서의 Swm의 형성 깁스자유에너지(Gibbs free energy of formation), ΔGf(Swm)는 다음과 같이 주어진다.
| (5) |
식(5)에서 ΔHf(Swm)와 ΔSf(Swm)는 각각 Swm의 형성 엔탈피(enthalpy of formation) 및 형성 엔트로피(entropy of formation)이다. Majzlan et al. (2004)은 ΔHf(Swm)을 Swm의 용해 반응에 대한 열량을 측정으로부터 계산하고, ΔSf(swm)는 이론적으로 예측하여 식(5)로부터 ΔGf(Swm) 값을 보고하였다. 이를 이용하면 반응(R1)의 깁스에너지 변화 ΔGr을 다음과 같이 계산할 수 있다:
| (6) |
반응(R1)의 평형 상수 Ksp는 ΔGr로부터 아래와 같이 계산할 수 있다.
| (7) |
식 (7)에서 R은 이상기체상수(ideal gas constant)이다.
3. 용해도 비교
표 1은 지금까지 보고된 Swm의 자료를 정리한 것이다. 이 표에는 Swm의 황산이온 함량(x), 용해도적(solubility product) 값, 용해도적 평가 방법, 그리고 참고 문헌이 표시되어 있다. 이 표를 통해 지금까지 보고된 Swm의 황산 이온의 함량 및 용해도적 값이 학자들마다 매우 다름을 알 수 있다. 특히 Caraballo et al. (2013)은 0.75<x<2.58 및 –39.5 <pKsp< -5.8의 값을 갖는다는 것을 밝혀, 그 이전의 연구자들이 생각한 것보다 Swm의 황산 이온의 함량 및 용해도 변화의 폭이 훨씬 큼을 주장하였다.
단순히 보고된 pKsp 값을 비교할 경우, pKsp=-18 부근의 값(Bigham et al., 1996; Regenspurg et al., 2004; Sánchez-España et al., 2011)과 pKsp=-10 이하의 값(Yu et al., 1999; Kawano and Tomita, 2001; Yu et al., 2002; Majzlan et al., 2004)로 크게 구분됨을 알 수 있다. 그동안 많은 연구자들은 그들의 연구 결과로 얻어진 pKsp 값을 다른 연구자의 결과와 비교하여, 어떤 값이 적절하다는 식의 토론을 하여왔다.
지금까지 이미 알려진 바와 같이, Swm의 화학 조성은 일정한 범위 내에서 변할 수 있다. 특히, 황산 이온의 함량, 이에 따른 수산기의 함량, 그리고 물(아마도 구조수)의 함량이 시료마다 다른데, 이는 Swm의 용해도가 이들 성분에 따라 달라져야 함이 당연함을 의미한다. 그러므로 Swm의 화학 조성 변화에 대한 고려 없이 pKsp 값을 비교하는 것은 타당하지 않음을 나타낸다. Caraballo et al. (2013)은 이 점을 정확히 지적하였으며, 아래와 같이 pKsp가 황산 이온의 함, 즉 x의 함수임을 주장하였다:
| (8) |
그림 3은 반응(R1)에 대한 pKsp 값이 Swm의 황산 이온 함량 x에 따라 어떻게 변하는지 보여주는 그래프이다. Caraballo et al. (2013)의 값을 제외한 표 1의 모든 값을 이 그래프에 도시하면(검은 점), 마치 pKsp와 x는 전혀 상관이 없는 것처럼 보인다. Caraballo et al. (2013)의 자료 즉, 식(8)을 이 그래프에 도시하면(직선) 점선으로 표시한 타원 안에 들어 있는 두 자료, Kawano and Tomita (2001)과 Majzlan et al. (2004)의 값을 제외하면 모두 이 식에 부합되는 것을 볼 수 있다.
4. 토 론
표 1에 정리된 것처럼 Swm의 용해도는 이 광물이 처음 보고된 이후(Bigham et al., 1990) 지금까지 꾸준히 보고되었다. 하지만, 연구자들마다 다른 값을 보고하였는데, 이는 용액의 Swm에 대한 포화 정도, 시료 채취시의 여과에 의한 영향, 용해도 계산에 사용된 열역학 자료의 차이, Swm의 준안정성 및 시료의 순도, 화학 조성의 차이 등이 그 원인일 수 있다.
지금까지의 많은 연구들은 현장에서 직접 채취한 용액 시료를 분석한 결과를 바탕으로 용해도를 계산하여 보고하였다. 문제는 이들 용액 시료가 Swm에 대해 포화되어 있다는 점을 확신할 수 없다는 것이다. 지하수, 지표수, 광산 배수 등 자연계의 물은 언제나 불포화 또는 과포화되어 있을 가능성이 있다. 이 경우 용해 반응(R1)의 평형을 가정하여 계산한 용해도 값은 맞지 않게 된다. 실내 합성 또는 적정 실험을 통해 용해도를 계산한 연구도 있는데, 이 경우도 마찬가지로 용액의 과포화 가능성이 있다. 연구자들은 이러한 이유 때문에 각 시료별 용해도를 따로 계산하기 보다는, 많은 시료들의 활동도를 그래프에 나타내고 이로부터 전체적인 경향을 파악하고 최소값을 선택하여 용해도로 보고하는 경우가 대부분이다.
용액 시료는 대부분 여과한다. 보통은 0.45 또는 0.2 μm의 공극 크기를 갖는 여과지를 사용하여 여과하는데, 미량 원소를 분석하기 위해서 또는 부유물에 의한 분석 오차를 좀 더 줄이기 위해 0.1 μm 공극 크기의 여과지를 사용하기도 한다. 문제는 공극 크기가 작은 여과지를 사용할수록 여과하는 시간이 기하급수적으로 증가한다는 것이다. 산성광산배수(AMD; acid mine drainage)는 Swm이나 페리하이드라이트와 같은 광물이 정출되는 대표적인 물인데, 이 AMD는 시료를 채취하는 동안 실시간으로 산화가 일어나는 경우가 많다. 여과에 너무 많은 시간이 걸리면, 여과하는 동안 이미 평형에 도달한 물이 추가로 산화되어 pH와 EH와 같은 현장 측정 수질 값이 변화하고 추가로 용존 성분들이 침전되어 제거되면서 후에 분석하는 용존 성분의 함량이 달라질 우려가 있으며, 이 때문에 용해도의 평가에 오류가 있을 수 있다.
용해도 또는 Ksp를 계산하기 위해서는 반드시 기존의 열역학 자료를 이용하여야 한다. 우리는 흔히 내부적 일관성(internal consistency)가 검증된 열역학 자료 세트(thermodynamic data set)를 사용하는데, 대표적인 열역학 자료 세트의 예로는 Robie and Hemingway (1995), Ball and Nordstrom (1991), Zimmer et al. (2016) 등이 있다. 주어진 화학종에 대한 열역학 함수 값 또는 반응에 대한 평형 상수 값은 이들 자료 세트끼리 서로 조금씩 다를 수 있다. 이런 이유로, 연구자들은 열역학 계산을 할 때 여러 자료 세트를 혼용하는 것을 가급적 피하려고 하며, 이렇게 계산된 값은 계산에 사용된 자료 세트와만 함께 사용하는 것이 바람직하다. 그러므로, 같은 반응에 대해 서로 다른 열역학 자료 세트를 이용하여 얻은 평형 상수 값들은 서로 조금씩 다를 수 있으며, 종종 피치 못하게 여러 자료 세트를 이용하여 계산한 경우 내부적 일관성을 유지 못할 수도 있다.
Swm은 준안정한(metastable) 광물로서, 시간이 지남에 따라 저절로 자로사이트(jarosite)나 침철석으로 바뀐다(Acero et al., 2006). Swm이 자연계에서 흔히 관찰되는 이유는 다른 준안정한 광물들과 마찬가지로 아마도 반응속도론(kinetics)적인 측면에서 이들 광물이 좀 더 쉽게 정출되기 때문인 것으로 짐작된다. 자연계에서 채취된 많은 시료에서 Swm과 자로사이트 혹은 침철석이 섞여 관찰되는데, 이는 먼저 정출된 준안정한 Swm이 시간이 지나면서 점차 안정한 자로사이트 및 침철석으로 전이하기 때문인 것으로 생각된다. 만일 침철석으로의 전이 반응이 일어나면 물의 용존 성분 농도가 반응(R1) 또는 (R3)와 같은 Swm의 용해에 의해 조절되는 것이 아니라 다음과 같은 전이 반응에 의해 조절된다:
| (R4) |
| (R5) |
이 반응의 반응 화학량(stoichiometry)는 용해 반응과 완전히 다르며, 따라서 이 반응에 의해 용존 성분이 규제되는 시료를 분석하여 pKsp를 계산하는 것은 중대한 오류를 초래한다.
앞서 이미 설명한 것처럼 Swm이 이상적인 화학식은 Fe8O8(OH)6SO4이지만, 실제로는 Fe8O8(OH)8-2x(SO4)x의 화학식으로 표현하여 화학 조성이 가변적임을 나타낸다. Bigham et al. (1994)은 x가 1 내지 1.75 사이의 값을 갖는다고 보고하였지만, 나중에 다른 연구자들에 의해 이보다 훨씬 넓은 범위의 값을 갖는다고 밝혀졌다(Caraballo et al., 2013). 만일 Swm이 정말 하나의 광물이라면, 이와 같은 조성의 변화는 Swm이 고용체를 이루기 때문일 것이다. Swm의 용해도는 당연히 단성분(end member)의 비율에 따라 달라질 것이며, 따라서 일정 범위의 화학 조성을 갖는 Swm에 하나의 대표 용해도를 표시하기보다는, 화학 조성에 따라 변화하는 용해도를 표시하는 것이 타당할 것이다.
만일 Swm이 두 단성분간의 고용체라면, 우선 당초 Bigham et al. (1994)에 의해 보고된 화학식을 고려할 때 Fe8O8(OH)6SO4-Fe8O8(OH)4(SO4)2 간의 고용체(SS1)을 생각해 볼 수 있다. 이 SS1 경우 1≤x≤2의 값을 가져야 하는데, 앞서 언급한대로 이 범위를 넘어서는 x값이 보고된 바가 있다. Swm이 자연계에서 단일 광물로 발견되는 단성분 간의 고용체일 수도 있다. 예를 들면, FeOOH-Fe(SO4)1.5 간의 고용체(SS2)를 생각해볼 수 있다. 고용체를 이루는 단성분들은 비슷한 결정 구조를 갖는데, 이 경우 많은 동질 이상 중에 아카가나이트-코넬라이트(akaganeite-kornelite) 간의 고용체가 가능성이 있다. 이 두 광물은 모두 단사정계의 주상 결정형(monoclinic prismatic)을 갖는다. SS2의 화학식은 Fe8O8-2x/3(OH)8-2x/3(SO4)x이 되는데 이는 흔히 제시되는 Swm의 일반 화학식 Fe8O8(OH)8-2x(SO4)x와 산소, 수산기 및 황산기의 함량에 있어 차이가 있다.
고용체 Swm의 몰당 깁스자유에너지 은 아래와 같이 표현할 수 있다.
| (9) |
위 식에서 X1은 단성분 1의 몰비, μo는 표준 화학포텐셜, R은 기체 상수, T는 절대 온도, λ는 활동도 계수이며, 는 대괄호로 묶인 첫 번째, 두 번째 및 세 번째 항으로서, 각각 단성분의 물리적 혼합, 고용체 형성으로 인한 무작위 배열, 및 실제 고용체 형성으로 인한 깁스자유에너지를 나타낸다. 이렇게 계산된 을 식(6)의 ΔGf(Swm)에 대입하고, 식(7)을 이용하면 Swm의 용해도를 화학 조성에 따라 계산할 수 있다. 이렇게 계산된 pKsp 값은 식(9)가 나타내듯 선형 비례하는 와 단성분 몰비의 로그 함수 에 따라 변할 것이지만, 일반적으로 에 비해 의 값이 매우 작아, pKsp 값은 마치 직선식에 따라 변하는 것처럼 보일 것이다.
SS1의 단성분에 대한 열역학적 자료는 아직 명확히 알려진 것이 없으므로 위와 같은 과정을 따라 pKsp 값을 계산하기는 어렵다. Caraballo et al. (2013)은 지금까지 보고된 x와 pKsp 값에 대해 회귀분석하여 식 (8)을 얻었음은 이미 언급하였다. 그림 3는 표 1에 정리된 pKsp 값을 x값에 따라 도시한 것으로, Majlzan et al. (2004)와 Kawano and Tomita (2001)을 제외한 대부분의 용해도 값이 식 (8)에 부합하는 것을 볼 수 있다. SS2의 단성분에 대한 정확한 열역학적 자료는 매우 부족하며, Lemire et al. (2013)의 자료를 바탕으로 대략적인 근사값()을 이용해 Swm의 용해도를 계산하면 그동안의 연구자들이 보고한 용해도 값과 너무 많은 차이를 보인다. 이는 고용체 단성분 설정에 오류가 있거나, 단성분의 열역학적 자료가 부정확하기 때문이며, 이에 대해서는 후에 좀 더 자세히 연구해 볼만한 가치가 충분하다.
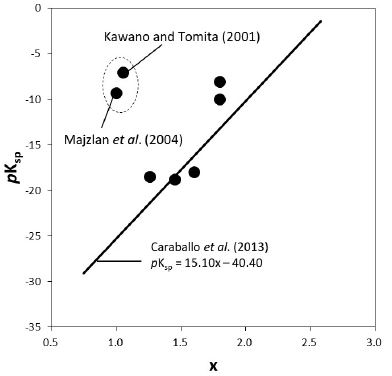
Comparison of the pKsp values as a function of the sulfate contents (x) of schwertmannite in Table 1. The solid line represents the equation given by Caraballo et al. (2013).
Swm이 실제로 고용체를 이루는지는 분석된 Fe와 S의 몰비를 살펴보면 알 수 있다. SS1 및 SS2의 화학식을 기반으로 이론적으로 계산한 Swm 1g 당 Fe 및 S의 몰 수는 다음과 같은 관계를 갖는다:
| (10) |
또한 Fe/S 몰비와 S의 몰수와의 관계는 다음과 같다:
| (11) |
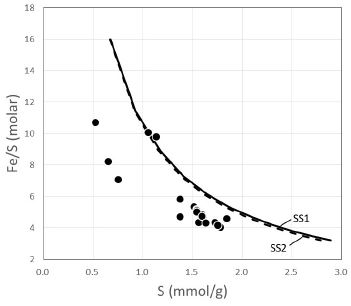
식 (11)에서 M은 Swm의 식량(formula weight)이다. 그림 4와 5는 각각 위 식 (10) 과 (11)에 의해 예측된 Fe와 S의 몰 수 관계 및 Fe/S와 S 몰 수와의 관계를 실제 데이터와 비교해 보여주는 것으로, 이론적으로 예측된 몰 수와 실제 분석된 몰 수가 매우 다른 것을 알 수 있다. 만일 분석 값이 정확하다면, 이 결과는 분석된 시료가 불순물을 상당히 포함하고 있거나 또는 실제로 Swm이 고용체를 이루지 않는다는 것을 의미한다. 용해도를 보고한 대부분의 시료들은 XRD 등을 통해 시료의 순수성을 검증하므로, 전자 보다는 후자일 가능성이 높다. 최근 합성 및 자연산 Swm에 대해 HRTEM으로 관찰한 결과, Swm은 단일 광물이 아니라 수화철산화물(hydrous ferric oxide; HFO)의 나노 결정과 이를 둘러싼 황산이온 성분이 풍부한 기질의 혼합물일 가능성이 높다고 보고하였다(Hockridg et al., 2009; French et al., 2012). 이 연구에서 Swm의 화학식으로부터 계산된 Fe 및 S의 몰비를 분석된 값과 비교한 결과는 Swm이 역시 단일 고용체가 아님을 지시하며, 이에 대한 좀 더 깊은 연구가 필요함을 지시하고 있다.
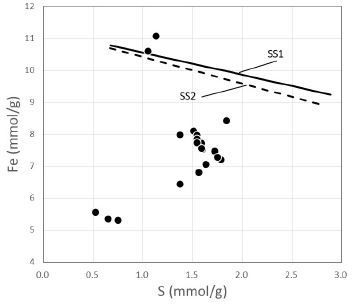
Plot of the number of moles of Fe against the number of moles of S in 100 g of schwertmannite. The solid and broken curve represent theoretically calculated values for the solid solution 1 (SS1) and 2 (SS2), respectively. See the text for the detailed explanation of the solid solutions. The measured data obtained from the literatures listed in Table 1.
5. 결 론
Fe8O8(OH)8-2x(SO4)x의 화학식을 갖는 Swm의 x 값과 용해도(pKsp) 값은 그동안 연구자들마다 달리 보고되어 논란이 지속되어 왔다. 이처럼 그 값이 다른 것은 용액의 Swm에 대한 포화 정도, 시료 채취시의 여과에 의한 영향, 용해도 계산에 사용된 열역학 자료의 차이, Swm의 준안정성 및 시료의 순도, 화학 조성의 차이 등의 이유 때문일 수 있는데, 이 중 가장 큰 원인은 화학 조성의 차이 즉 x 값이 다르기 때문일 것으로 생각된다. 많은 연구자들에게 알려진대로, Swm의 화학 조성, 특히 x 값이 일정 범위 내에서 연속적으로 변한다면 Swm은 당연히 고용체일 것이다. 고용체 Swm은 단성분 간의 혼합으로 그 화학 조성을 나타낼 수 있어야 하며, 이 혼합 비율의 함수로 그 깁스자유에너지 혹은 그 용해도를 표시할 수 있어야 한다. 이 연구에서 살펴본 Swm의 단성분 조합은 두 가지이나, 경우에 따라 다른 가능한 단성분 조합이 가능할 수도 있다. 어떤 경우의 단성분 조합이던, 대개의 Swm의 단성분에 대한 정확한 열역학적 자료가 부족한 상태이므로 안타깝게도 적절한 열역학적 모델에 따른 단성분 비율의 함수인 용해도를 계산하는 것은 현재로서는 불가능하다. 다만, 그동안 보고된 용해도 값을 x 값에 따라 도시하면 분명한 상관성을 보여, 고용체로서의 Swm의 용해도를 예측하는 것이 어느 정도 가능성이 있으며, 이에 대한 좀 더 깊은 연구가 필요함을 나타내고 있다.
문제는 Swm이 정말 고용체인가 하는 점이다. Swm의 화학식으로부터 Fe와 S의 몰 수를 계산한 것과 실제 시료로부터 분석된 몰 수를 비교하면, Swm이 단일 고용체가 아니라 여러 상들의 혼합체임을 나타낸다. 이 경우, 단일 고용체 상을 가정하여 계산된 지금까지의 용해도는 대부분 그 의미를 잃어버리게 된다. 이 연구에서 살펴본 것은 단순 화학식에 의한 몰비이며, 아직 연구자들 사이에서는 Swm이 정말 고용체인가 하는 점에 대해서는 의견이 일치하지 않고 있다. 따라서 이 점에 대해서도 좀 더 심도 있는 연구가 진행될 수 있길 기대한다.
Acknowledgments
이 연구는 2016년도 강원대학교 대학회계 학술연구조성비(관리번호 – 520160153) 및 한국과학재단 선도연구자사업(관리번호 – C1001838-01-01)의 지원을 받아 수행하였음.
References
-
Acero, P., Ayora, C., Torrento, C., and Nieto, J.M., (2006), The behavior of trace elements during schwertmannite precipitation and subsequent transformation into goethite and jarosite, Geochimica et Cosmochimica Acta, 70, p4130-4139.
[https://doi.org/10.1016/j.gca.2006.06.1367]

- Ball, J.W., and Nordstrom, D.K., (1991), User’s manual for WATEQ4F, with revised thermodynamic data base and test cases for calculating speciation of major, trace, and redox elements in natural waters, USGS Open File Report, p91-183.
-
Bigham, J.M., Carlson, L., and Murad, E., (1994), Schwertmannite, a new iron oxyhydroxysulphate from Pyhasalmi, Finland, and other localities, Mineralogical Magazine, 58, p641-648.
[https://doi.org/10.1180/minmag.1994.058.393.14]

- Bigham, J.M., Schwertmann, U., Carlson, L., and Murad, E., (1990), A poorly crystallized oxyhydroxysulfate of iron formed by bacterial oxidation of Fe(II) in acid mine waters, Geochimica et Cosmochimica Acta, 54, p2743-2758.
-
Bigham, J.M., Schwertmann, U., Traina, S.J., Winland, R.L., and Wolf, M., (1996), Schwertmannite and the chemical modeling of iron in acid sulfate waters, Geochimica et Cosmochimica Acta, 60, p2111-2121.
[https://doi.org/10.1016/0016-7037(96)00091-9]

- Caraballo, M.A., Rimstidt, J.D., Macías, F., Nieto, J.M., and Hochella Jr., M.F., (2013), Metastability, nanocrystallinity and pseudo-solid solution effects on the understanding of schwertmannite solubility, Chemical Geology, p360-361, 22-31.
- Fernández-Martínez, A., Timon, V., Román-Ross, G., Cuello, G.J., Daniels, J.E., and Ayora, C., (2010), The structure of schwertmannite, nanocrystalline iron oxyhydroxysulfate, American Mineralogist, 95, p1312-1322.
-
French, R.A., Caraballo, M.A., Kim, B., Rimstidt, J.D., Murayama, M., and Hochella, M.F., (2012), The enigmatic iron oxyhydroxylsulfate nanomineral schwertmannite: morphology, structure and composition, American Mineralogist, 97, p1469-1482.
[https://doi.org/10.2138/am.2012.4032]

-
Hockridge, J.G., Jones, F., Loan, M., and Richmond, W.R., (2009), An electron microscopy study of the crystal growth of schwertmannite needles through oriented aggregation of goethite nanocrystals, Journal of Crystal Growth, 311, p3876-3882.
[https://doi.org/10.1016/j.jcrysgro.2009.06.023]

-
Kawano, M., and Tomita, K., (2001), Geochemical modeling of bacterially induced mineralization of schwertmannite and jarosite in sulfuric acid spring water, American Mineralogist, 86, p1156-1165.
[https://doi.org/10.2138/am-2001-1005]

- Lemire, R.J., Berner, U., Musikas, C., Palmer, D.A., Taylor, P., and Tochiyama, O., (2013), Chemical Thermodynamics of Iron Part 1. OECD, NEA Chemical Thermodynamics Series No. 13, p1082.
-
Majzlan, J., Navrotsky, A., and Schwertmann, U., (2004), Thermodynamics of iron oxides: Part III. Enthalpies of formation and stability of ferrihydrite (~Fe(OH)3), schwertmannite (~FeO(OH)3/4(SO4)1/8), and ε-Fe2O3, Geochimica et Cosmochimica Acta, 68, p1049-1059.
[https://doi.org/10.1016/s0016-7037(03)00371-5]

- Parkhurst, D.L., and Appelo, C.A.J., (2013), Description of input and examples for PHREEQC version 3--A computer program for speciation, batch- reaction, one-dimensional transport, and inverse geochemical calculations: U.S. Geological Survey Techniques and Methods, book, 6, chap. A43, p497.
- Regenspurg, S., (2002), Characterisation of Schwertmannite-Geochemical Interactions with Arsenate and Chromate and Significance in Sediments of Lignite Opencast Lakes, Ph.D. Dissertation, Bayreuth University, p124.
- Regenspurg, S., Brand, A., and Peiffer, S., (2004), Formation and stability of schwertmannite in acidic mining lakes, Geochimica et Cosmochimica Acta, 68, p1185-1197.
- Robie, R.A., and Hemingway, B.S., (1995), Thermodynamic properties of minerals and related substances at 298.15 K and 1 bar (105 pascals) and at higher temperatures, U.S. Geological Survey Bulletin, 2131, p461.
- Sánchez-España, J., Lopez Pamo, E., Santofimia, E., Aduvire, O., Reyes, J., and Barettino, D., (2005), Acid mine drainage in the Iberian Pyrite Belt (Odiel river watershed, Huelva, SW Spain): geochemistry, mineralogy and environmental implications, Applied Geochemistry, 20, p1320-1356.
-
Yu, J.-Y., (1996), Precipitation of Fe and Al compounds from the acid mine waters in the Dogyae area, Korea: A qualitative measure of equilibrium modeling applicability and neutralization capacity?, Aquatic Geochemistry, 2, p81-105.
[https://doi.org/10.1007/bf00240854]

-
Yu, J.-Y., Heo, B., Choi, I.-K., Cho, J.-P., and Chang, H.-W., (1999), Apparent solubilities of schwertmannite and ferrihydrite in natural stream waters polluted by mine drainage, Geochimica et Cosmochimica Acta, 63, p3407-3416.
[https://doi.org/10.1016/s0016-7037(99)00261-6]

-
Yu, J.-Y., Park, M., and Kim, J., (2002), Solubilities of synthetic schwertmannite and ferrihydrite, Geochemical Journal, 36, p119-132.
[https://doi.org/10.2343/geochemj.36.119]

-
Zimmer, K., Zhang, Y.L., Lu, P., Chen, Y.Y., Zhang, G.R., Dalkilic, M., and Zhu, C., (2016), SUPCRTBL: A revised and extended thermodynamic dataset and software package of SUPCRT92, Computer and Geosciences, 90, p97-111.
[https://doi.org/10.1016/j.cageo.2016.02.013]