
백룡동굴 입구부 튜파(tufa)의 미생물 구조와 그 분포 특성
Copyright © 2017 The Geological Society of Korea
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/ which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
초록
다양한 환경조건에서 형성되는 미생물 매트(microbial mat)는 크리티컬존(critical zone) 내에서 발생되는 미생물 활동과 광물형성(또는 분해) 사이의 관계를 밝히는데 매우 중요한 요소로 알려져 있다. 국내 석회동굴 입구부에서 형성되는 튜파(tufa)의 표면에는 미생물 매트가 발달되어 있으나, 아직까지 동굴환경의 튜파를 대상으로 지질학적 연구가 진행된 바는 없다. 이 연구에서는 국내에서 처음으로 강원도 평창군 소재 천연기념물 제260호 백룡동굴 입구부에서 관찰되는 튜파의 미생물 구조 및 그 분포를 보고하고자 하였다. 동굴 입구로부터 내부로 순차적으로 채취한 시료들을 대상으로 퇴적암석학적 관찰을 실시한 결과, 각 시료 별로 큰 차이를 보이고 있지만 대부분 클랏 조직(clotted texture)을 보이며, 다양한 형태 및 구성성분으로 이루어진 필라멘트 조직(filamentous texture)을 포함하고 있다. 일부 시료들에서는 이러한 두 조직적 특성이 극히 우세하며 때때로 서로 반복적인 특성을 보이기도 한다. 이와 같은 두 조직은 일반적인 기상수(meteoric water) 환경에서 성장하는 동굴생성물의 결정질 조직과는 매우 다른 특징으로서, 시료의 표면부분 위에 형성되었던 과거의 미생물 매트로 판단된다. 주사전자현미경 관찰을 통해 각 시료로부터 규조류, 필라멘트 사상체, 구형 박테리아 등 매우 다양한 미생물 구조가 확인되었고 관찰된 클랏 및 필라멘트 조직이 미생물 매트에 해당됨을 검증하였다. 미생물 구조의 형태, 크기, 배열상태를 기준으로 미생물 구조의 다양성을 파악한 후 그 분포 특성을 상호비교한 결과, 동굴 입구에서 내부로 진행하면서 점진적으로 미생물 구조의 다양성이 감소할 것이라는 일반적인 예상과는 달리 동굴 입구부에서 점진적으로 다양성이 증가하다가 특정 지점을 기점으로 다양성이 급격히 감소하는 특징적인 변화경향이 관찰되었다. 이러한 변화경향은 현재까지 알려져 있는 동굴환경의 생물다양성 분포 측면에서 볼 때 이례적인 연구결과로서 백룡동굴 입구부의 지질학적, 지형학적, 미기후학적 특성을 반영하고 있는 것으로 해석된다. 이 연구의 결과는 각 동굴 별 특성에 따라 매우 독특한 미생물 매트가 형성될 수 있고 이에 따라 광물의 상호작용이 매우 다양하게 발생될 수 있음을 암시하며, 향후 여러 동굴환경에서의 검증과 함께 이러한 경향성의 요인을 파악하는 추가 연구가 필요하다.
Abstract
Microbial mats which formed at various terrestrial environments including the Earth’s critical zone have a significant implication on the relationship between microbial activities and formations (and/or degradations) of minerals. Up to date, however, there is no geological survey for the microbial mats of tufa deposits in a twilight zone of Korean limestone caves. In this study, we aimed to report a variety of microbial structures and their distributions on tufa deposits in the Baeg-nyong Cave (Natural monument no. 260), Pyeongchang, South Korea. The sedimentary petrographic results for 7 tufa specimens collected near the cave entrance show that both of clotted and filamentous textures are largely dominant and their detailed types are different from each other. These characteristics of the tufa deposits are clearly different from those of the typical meteoric speleothems composed mainly of clean carbonate crystals and may indicate the past presence of microbial mats on the surface. Through the scanning electron microscopy, we have identified the various shapes of microbial structures including diatoms, hyphal filaments and coccoids. The microbial structures observed in this study have been classified to 2 and 7 types of coccoids and filaments, respectively, based on shape, size and arrangements between individual structures. Interestingly, our results show that the diversity of microbial structures in the Baeg-nyong Cave is gradually increasing to the inner cave with a distinct threshold area which is abruptly decreased in the microbial structural diversity. This may imply that an entrance area of the limestone cave is one of the microbe growth stimulating environments and has been affected by complex factors on geological, geographical and micro-meteorological conditions.
Keywords:
microbial mat, clotted texture, filamentous texture, microbial diversity, cave environments키워드:
미생물 매트, 클랏 조직, 필라멘트 조직, 미생물 다양성, 동굴환경1. 서 론
국내 동굴환경에서 형성되는 민물 탄산염암은 동굴의 영구암대에서 형성되는 동굴생성물(speleothem)과 지표-동굴환경 전이구간에 해당되는 동굴 입구부의 튜파(tufa)로 나눌 수 있다. 현재까지 동굴생성물은 주로 무기적인 원인(Dreybrodt, 1982; Atkinson, 1983; Harmon et al., 1983; Ford and Willams 1989; Gordon et al., 1989)에 의해서만 형성된다고 알려져 왔으나, 최근 연구결과에 따르면 곡석(Helictite)과 같은 일부 동굴생성물의 경우 미생물이 관여 했을 가능성이 제기되기도 하였다(Tisato et al., 2015). 이에 반해 동굴 입구부의 경우 왕성한 미생물 활동이 이루어지고 있는 것으로 보고되었고(Taborosi et al., 2005; Brasier et al., 2015), 이러한 미생물들은 군집을 이루면서 다양한 두께의 미생물 매트(microbial mat)를 형성시키고 이를 반복하면서 최종적으로는 튜파 발달에 영향을 끼치는 것으로 받아들여지고 있다. 이러한 미생물 매트의 이해가 중요한 이유는 최근 들어 미생물과 무기적인 광물과의 상호작용이 지표환경에서 매우 중요한 부분을 차지하고 있는 것으로 평가받고 있기 때문이다. 예를 들면, 미생물 매트는 화학적 평형 상태로 존재하고 있는 탄소의 산화 환원 조건에 영향을 미쳐 주변 물의 pH와 탄산염광물 포화도를 변화시키기도 한다(Dupraz et al., 2009). 미생물 매트의 광물형성 작용은 크게 탄산염 광물의 침전에 간접적으로 기여하는 BIC (biologically-induced mineralization; Franke and Bazylinski, 2003; Weiner and Dove, 2003)와 미생물 세포의 활동이 직접적으로 광물을 형성시키는 BCM (biologically-controlled mineralization)으로 나눌 수 있다(e.g., Weiner and Dove, 2003).
미생물 매트 내에 존재하는 미생물 구조 연구는 다양한 방법으로 시도되고 있는데(Taborosi et al., 2005; Brasier et al., 2015; Tisato et al., 2015), 구성 미생물의 종류를 조사하기 위해 다양한 염기서열 분석법 등의 분자생물학적 기법을 이용한 연구가 시도되고 있으며(Cuezva et al., 2012), 실제로 특정 미생물이 탄산염 광물을 형성하는지 알아보기 위해 배양 실험도 활발히 이루어지고 있다(Cacchio et al., 2004; Reitschuler et al., 2016). 특히, 지질학 분야에서는 주로 자연계에서 관찰되는 유무기적 미세조직에 관한 연구가 현재까지 활발하게 이루어져 왔으며(Canaveras et al., 2006), 다양한 규모에서의 관찰 연구를 통해 미생물과 광물형성 사이의 관계를 밝히기 위한 노력이 시도 되고 있다(Manzo et al., 2012; Perri et al., 2012). 최근에는 식생의 최상부부터 지하수 대수층의 최하부까지를 이르는 소위 크리티컬존(critical zone) 연구와 맞물려 미생물과 무기물질 간의 상호작용에 관한 과학적 관심이 날로 증가하고 있다.
동굴 입구부는 다음과 같은 측면에서 미생물 매트를 연구하는데 매우 이상적인 조건을 갖추고 있다. 첫 번째로 동굴 입구부는 상대적으로 지표동식물의 영향이 점진적으로 감소하는 반면, 미생물이 증식하기에는 적합한 장소를 제공하고 있다. 둘째, 동굴 입구부는 햇빛, 온도, 습도, 대기물질 등 다양한 환경요소를 제한하기에 적합하다. 셋째, 다양한 종류의 동굴을 연구한다면 다양한 종류의 무기물과의 상호작용 연구가 가능하다는 점을 들 수 있다. 일반적으로 동굴 입구에 가까울수록 미기후 변동이 빈번하고 생물 다양성이 풍부하여 동굴 입구부에서 형성된 튜파일수록 더욱 불규칙한 내부 조직을 형성하는 것으로 보고된 바 있다(Taborosi et al., 2005).
국내에는 최소 1,000여개 이상의 석회동굴이 강원도 동남부부터 충청북도 북부까지 폭넓게 분포하고 있는 것으로 알려져 있으며, 이러한 동굴의 입구부에는 다양한 규모의 튜파가 발달하고 있다. 하지만 이러한 국내 동굴 입구부의 튜파는 현재까지 과학적으로 연구된 바 없이 단순한 조사차원의 기재에 그치고 있다. 이번 연구에서는 국내에서 처음으로 천연기념물 제260호로 지정되어 있는 강원도 평창군 소재 백룡동굴의 입구부로부터 채취한 튜파를 통해 국내 동굴 입구부에서 산출되는 튜파의 미생물 구조를 관찰하였다. 최종적으로는 이번 연구를 통해 동굴 외부로부터 내부로 전이되는 과정에서 미생물 구조가 어떠한 변화를 보이는지 확인하고자 하였다. 마지막으로 이번 연구를 통해 동굴 입구부에서의 미생물 매트 형성과정, 미생물 구조, 미생물과 환경요소와의 관계, 미생물과 광물형성과의 관계 등 다양한 주제의 향후 연구 가능성에 대해 고찰하였다.
2. 연구배경
백룡동굴은 행정구역상 강원도 평창군 미탄면 마하리 산1번지에 소재해 있으며, 북위 37° 16' 10”, 동경 128° 34' 54”에 위치한다(그림 1a). 백룡동굴의 입구는 영월 동강의 수면으로부터 약 15 m 상부인 해발 235 m 지점에 위치해 있다(우경식 외, 2006). 백룡동굴 입구의 배후사면은 급경사 산지 지형을 보이며, 해발 약 882 m의 백운산으로 연장된다. 백룡동굴 입구부의 특징은 동굴 내부로 약 15 m 직진 후 경로가 급격하게 90°방향으로 전환되는 동굴 미지형으로 대표될 수 있으며(그림 1b; Woo et al., 2006), 이러한 통로 형태는 외부 기후 요소 중 일부(조도 등)를 빠르게 변화시킬 수 있다.
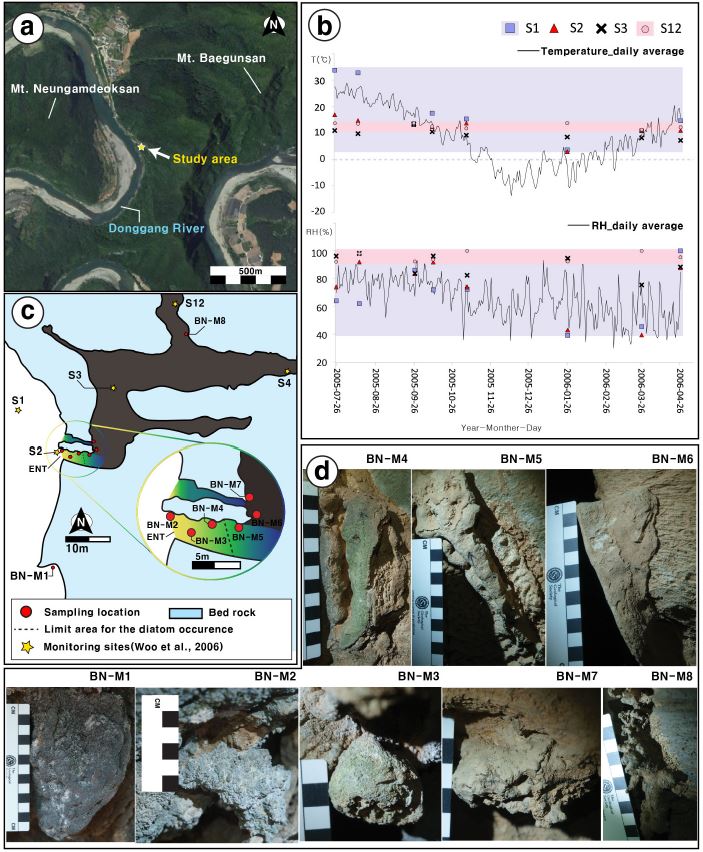
A geographic setting of the Baeg-nyong Cave and the sampling locations in the twilight zone. (a) A stellite image of the study area with the entrance of the Baeg-nyong Cave (a red arrow). (b) A sketch map of the entrance area in the cave. Red circles denote sampling locations. Stars indicate monitoring sites for measuring temperature and relative humidity (Woo et al., 2006). (c) A year-long monitoring results on temperature and relative humidity of the cave. The cave data are from Woo et al. (2006) while the continuous data in Yeongweol area are from the Korean Meteorological Administration. (d) Tufa specimens collected for this study.
백룡동굴 입구부의 미기후 변화는 동굴 외부에서 계절변화와 일변화를 모두 보이며, 내부로 갈수록 이러한 변화 없이 안정된 양상을 보인다(그림 1b, 1c). 동굴 외부(S1)의 온도는 여름철과 겨울철에 최대 30℃ 차이를 보이며 입구(S2)에서도 최대 15도 차이나지만 동굴 내부(S4~S12)에서는 11~13.5도 범위로 상대적으로 매우 안정된 대기 조건을 보여준다(그림 1c). 동굴 외부 대기와 내부 대기가 영향을 미치는 장소의 경우, 상대습도가 39%에서 92%의 넓은 범위로 나타나며, 주로 동굴 내부 대기의 영향만 받는 지점에서는 미세한 변동을 제외하고 거의 95% 이상으로 일정하게 유지된다(그림 1c; Woo et al., 2006). 백룡동굴 동굴 주변의 지질은 전기 고생대 오르도비스기에 퇴적된 조선누층군 막골층에 해당되며, 주로 담회색 내지 암회색의 층리가 잘 발달한 석회암, 백운암질 석회암, 이질 석회암이 우세하다(Woo et al., 2006).
3. 연구방법
이번 연구에 활용된 시료는 동굴 보호를 고려하여 기존 파손된 부분 중 극히 일부분을 수거하는 방식으로 채취되었으며, 총 8개의 시료를 획득하였다(그림 1d). 시료번호 BN-M1은 동굴 외부 노두를 피복하고 있는 튜파이며, 동굴 입구로부터 내부로 가면서 순차적으로 7개의 시료(BN-M2~BN-M8)를 채취하였다. 시료번호 BN-M8은 햇빛이 도달하지 않는 영구암대에서 채취되었다. 시료채취 시 BN-M1, -M3, -M8을 제외하고 나머지 시료들은 동굴 진행 방향을 기준으로 좌측벽면을 따라 등간격(약 5 m)으로 채취되었다(표 1). BN-M1은 외부의 미기후 조건에 영향을 받은 미생물 구조를 나타낼 것으로 예상하여 채취하였다. 이에 반해 BN-M8은 동굴의 영구암대 조건에 따른 특징을 파악하기 위해 채취하였다.
육안 및 현미경 관찰을 위해 각 시료 별로 연마편 및 박편을 제작하였다. 제작된 박편은 편광현미경(Nikon ECLIPSE LV100N POL)을 이용해 직교 니콜 하에서 각각 10배, 40배, 100배로 관찰되었다. 구성광물을 구분하기 위해 Alizarin Red S 시약 및 Feigl’s 용액을 이용한 착색법이 적용되었다. 미생물 구조 관찰에는 주사전자현미경(COXEM, Model CX-200TM)을 이용하였으며, 실제 전자현미경 관찰용 미시료(subsample)는 각 시료의 표면부를 중심으로 핀셋 등을 이용하여 채취하였다. 그러나 표면이 이질 퇴적물로 피복되어 있는 경우, 이질 퇴적물 하부를 중심으로 전자현미경용 미시료를 채취하였다. 채취된 미시료들을 35℃의 오븐에서 5시간 동안 건조한 후 전도성테이프(carbon tape)를 이용해 시료대(stub) 위에 고정하였으며, 이온코팅기(ion coater, Model SPT-20) 내에서 440초 동안 금(Au)으로 도금되었다. 주사전자현미경 작동 조건은 가속전압 20 kV 하에서 working distance는 6 mm로 설정되었다. 주사전자현미경 관찰 시 반정량 EDS (Energy Dispersive Spectrometer) 분석이 점 분석(point analysis) 방식으로 병행되었다.
4. 연구결과
4.1 동굴 입구부 튜파의 퇴적암석학적 특성
시료 채취 전 입구부에서 관찰되는 민물 탄산염암의 표면에는 두께 약 1 mm 내외의 미생물 매트가 관찰되는데, 이는 동굴 외부 시료인 BN-M1에서부터 입구부 시료인 BN-M4 까지만 제한적으로 확인된다. 동굴외부에 위치한 BN-M1의 경우, 미생물 매트가 암회색 띠고, BN-M2부터 BN-M4 까지는 녹색으로 발달되어 있다(그림 1d). 녹색의 미생물 매트는 그림자 측면(shadow area)과 같이 동굴 내부를 바라보고 있는 면에서는 발달되지 않는 것이 특징으로 햇빛과 직접적인 관련 있는 것으로 판단된다. 표면에 미생물매트가 형성되지 않은 BN-M5와 BN-M6는 이질퇴적물이 표면을 피복하고 있다(그림 3f, 3g).
연마편 관찰을 바탕으로 각 시료의 조직적 변화를 파악한 결과, 동굴 외부와 입구 쪽에서 형성된 탄산염암은 전반적으로 공극이 매우 많고 불규칙적인 엽층리를 보이거나(그림 2a, 2b) 괴상으로 발달되는 반면(그림 2c), 동굴 내부로 갈수록 상대적으로 치밀한 조직을 보인다(그림 2f, 2h). 이러한 변화 특징이 관찰되는 부분은 시료번호 BN-M4 지점부터 BN-M6 지점 사이이다. BN-M4을 기준으로 더 동굴 외부에 가까운 지점에서는 엽층리가 매우 불규칙한 특징을 보이지만, BN-M4 지점 이후부터는 엽층리가 발달되기 시작하고 상대적으로 치밀한 조직을 보인다. 하지만 BN-M5에서는 BN-M4 시료에 비해 엽층리가 미약하게 발달하는 성긴 조직을 일시적으로 보였다가(그림 2e) 시료번호 BN-M6 이후 시료부터는 엽층리가 잘 발달된 치밀한 조직만 관찰된다(그림 2f).

Photographs of rock slabs for individual tufa specimens. Note that the upsides in all the photographs coincide with real orientations prior to the sampling.
비록 BN-M4와 BN-M5 사이에서는 동굴 내부에서 상대적으로 더 치밀한 조직을 보이는 특징이 나타나기는 하지만, 동굴 입구부와 영구암대로 나누어 보았을 때 두 영역에서 형성된 민물 탄산염암은 구성입자 및 결정조직에서 뚜렷한 차이를 나타낸다(그림 3). 박편 상에서 동굴 입구부에 위치하는 6개의 튜파 시료들은 주로 공극이 우세한 특징을 보이고 미크라이트질 입자로 구성되어 있다. 또한, 일부 스파라이트(sparite) 및 미정질 스파라이트(micro-sparite)가 미크라이트질 입자를 둘러싸거나 공극을 채우는 형태로 관찰되기도 한다(그림 3a-g). 이에 반해 영구암대에서 채취한 BN-M8는 이질물질이 피복하고 있는 표면부를 제외하고 주로 순수한 섬유상 내지 침상의 아라고나이트로 구성되어 있는 것을 확인할 수 있다(그림 3h). 각 시료들의 내부 조직에서는 표면부에서 관찰되었던 미생물 매트나 이질퇴적물층이 내부에도 반복적으로 형성되어 있음을 확인할 수 있다. 특히, 미생물 매트의 경우 박편 상에서는 클랏 조직(clotted texture)을 다량 포함하며, 필라멘트 조직(filamentous texture)을 나타내기도 한다(그림 3, 4). 필라멘트 조직들은 직경 약 1 ㎛ 에서 10 ㎛ 내외, 길이 약 100 ㎛ 에서 500 ㎛ 내외의 미크라이트질 입자로 관찰되며, 주변부는 미정질 스파라이트로 둘러싸여 있다. 이러한 필라멘트 구조들은 특히 시료번호 BN-M1에서부터 BN-M5 까지 매우 흔히 관찰된다(그림 4a, 4b, 4c, 4f, 4g).

Photomicrographs of thin sections from the surface parts of cave tufa deposits. All the images were taken under the cross polarized light. (a) The surface part of BN-M1. Central elliptical to circular micrite parts showing clotted texture (small character c) were covered by micro-spar calcite(sp). (b) BN-M2 which is similar with textural characters of BN-M1. (c-d) BN-M3. Filamentous textures(f) are very dominant. (e) BN-M4 showing the crudely contacted columnar calcite partly with clotted textures. (f) BN-M5. Filamentous textures are dominant. (g) BN-M6 showing the straight interfaces between individual columnar calcite crystals. (h) BN-M8. Sparite with clay layers in the outer surface.

A variety of microbial textures under the polarized microscope. (a), (c), (d), (f) and (g) Micritic filamentous structures observed in BN-1,BN-M3,BN-M4 and BN-M5 (arrows). (b) Clotted textures from BN-M2. (h) Equant, fibrous and acicular calcite crystals developed in BN-M7. Also, laminations produced by clay layers are well developed. (i) Radial aragonite in BN-M8. (j) Calcite textures in BN-M8. c = clotted textures, f = filamentous textures, s = spar, sp = micro-spar, fc = fibrous calcite, ar = aragonite, ca = calcite, p = peloids.
4.2 미생물 구조의 형태적 분류와 분포
이번 연구에서는 미생물의 종 구분을 목적으로 하지 않으므로 Bindschedler et al. (2010) 등에 제시된 기준에 근거하여 미생물 형태적 분류에 치중하였다. 이러한 형태적 분류는 미생물종별 상이성과 함께 같은 미생물 종이라도 활성도에 따라서도 영향 받을 수 있다. 주사전자현미경 관찰로 확인된 미생물 구조는 총 10가지 유형으로 구분되며, 구균체(coccoids) 2종류와 7가지 유형의 필라멘트 가 확인되었다(표 2). 이외에도 균류의 포자(fungal spore)로 추정되는 입자가 관찰되기도 한다(그림 5c).

SEM images showing microbial structures. (a-h) Various microbial structures observed only from BN-M1. (i-k) F2 type of filament. (l-n) The F3 type of filament on the surface of the BN-M4. (o) F4 type of filament.
동굴 외부의 BN-M1 표면부에서는 관찰된 미생물 구조 중 유형 C1, S, F1이 관찰된다. C1은 직경 약 1 ㎛ 이내의 주름진 형태를 보이는 구형체이다(그림 5a). 포자 추정 입자 S는 직경 약 10-18 ㎛로 C1보다는 큰 특징을 보이며(그림 5b, 5c), 이들은 쐐기 모양의 끝이 뾰족한 형태의 표면 부산물들로 덮여 있고 중심부 구체와 부산물 사이의 연결부분에서는 그물망 조직이 관찰된다(그림 5c arrowed). BN-M1 시료에서 C1, S, F1은 서로 독립적으로 존재하지 않고 뒤섞인 형태로 관찰된다(그림 5a, 5b, 5c). 미생물 구조 C2는 직경 1.5-1.6 ㎛ 범위로 BN-M2부터 BN-M8까지 거의 모든 곳에서 관찰되는데, 미생물 구조가 풍부한 동굴 입구부에서는 다른 미생물 구조들에 가려 관찰이 어렵지만 BN-M5부터는 우세하게 관찰된다. 특히 이들은 BN-M6 시료에서 몰드(mold) 형태의 기질과 함께 군집으로 관찰되기도 하며(그림 6o), C2들이 뭉쳐 칼슘(Ca)-규소(Si)-알류미늄(Al)을 포함하는 시트(sheet)상 물질을 형성하는 것이 관찰 되었다(그림 6n). 미생물 구조가 거의 관찰되지 않는 BNM8에서도 C2 형태의 구균체가 드물게 관찰된다.

(continued). (a) F4 type of filament. (a-d) F5 type of filament. (e-g) F6 type of filamnet. (h) and (i) F7 type of filament. (j-m) Unknown organic fragments (n) and (o) C2 type of coccoids.
미생물 구조 중 필라멘트형 구조들은 이번 연구를 통해 가장 다양한 형태로 분류될 수 있는 미생물 구조인데, 분절의 형태와 크기에 따라 F1부터 F7까지 7개의 형태로 분류하였다(표 2). F1은 외경이 약 1-5 ㎛인 필라멘트(filament) 형태의 미생물 조직이다. F1의 외부에서는 분절(segment)이 관찰되지 않으나 분해된 모습에서 4-8 ㎛ 간격의 분절 흔적이 관찰된다(그림 5f). F1은 시료 표면에 가까울수록 가지(branching)가 많이 발달하고 짧은 길이로 관찰되며, 표면은 매우 울퉁불퉁한 특징을 보인다(그림 5d). 일부에서는 F1이 긴 형태로 관찰되며 표면이 매끈하지만(그림 5g) 점액질(mucus)물질로 인해 미크라이트(micrite)가 부착된 형태로 관찰된다(그림 5e, 5h). F2은 짧은 막대 형태의 미생물 구조로 방해석 결정면 위를 덮거나 혹은 결정면에 포함된 형태로 관찰된다(그림 5i). 일부 F2형 필라멘트들은 매우 밀집된 군집을 이루면서 덩어리 형태를 보이기도 한다(그림 5j). F3형 필라멘트들은 BN-M4의 표면에서만 관찰되며, 군집형태로 관찰된다. F3는 불규칙한 형태의 분절들로 구성된 필라멘트로서, 복잡하게 얽혀있어 정확한 형태를 구분하기 어렵다(그림 5i, 5m). F4는 분절이 잘 관찰되는 필라멘트형으로 각각 분절들은 중심부가 움푹한 형태로 관찰된다(그림 5o, 6a). 각 분절의 반경(ED)은 약 0.4 ㎛-0.6 ㎛이며, 길이는 약 0.9-2.2 ㎛이다. F5는 전형적인 막대 형태의 분절로 이루어져 있으며(그림 6c, 6d), 이 막대 형태의 분절은 직경 약 0.4-0.7 ㎛, 길이 0.6-1 ㎛로 관찰된다. 이 형태의 필라멘트는 항상 다른 미생물 구조 표면에 부착된 형태로 산출된다(그림 6c). 일부 F5는 규조류 표면부에 연결된 것처럼 관찰되며, 연결부에서는 특징적인 고리형(ring) 구조를 볼 수 있다(그림 6b). F6는 가지가 가장 잘 관찰되는 필라멘트 구조로(그림 6e, 6f), 각 분절의 형태가 F3의 분절과 유사한 형태를 보인다. 이들은 분절의 직경이 0.4-0.7 ㎛이고 길이가 약 2 ㎛로 F3 분절과 크기도 유사하지만, F6는 가지의 발달 상태가 매우 우세하고 전반적으로 분절들이 감겨있는 형태를 보인다. F7은 BN-M5 시료에서만 관찰된 구조로, 짧은 타원형, 함몰된 타원형, 구형의 각 분절들이 긴 사슬형(chain)으로 연장되어 있다(그림 6h). F5와 유사하나 분절의 형태가 다양하고 크기가 약 3~4배 크다(표 2). U는 외경 약 2 ㎛, 내경 약 0.3 ㎛의 미확인 미생물구조로 때때로 납작한 사각형태, 부채꼴 형태로도 관찰된다(그림 6j, 6k, 6l, 6m)
미생물 구조의 분포를 보면 동굴 입구 지점과 내부 통로방향이 전환되는 지점에서 급격한 변화를 보이는 것으로 나타났다(그림 7). BN-M1 시료에서는 미생물 구조 유형 F1, C1, S가 우세하게 관찰되고 U가 드물게 관찰된다(그림 7). 동굴 입구 지점인 BN-M2부터 BN-M4까지는 규조류가 관찰되지만, BN-M5부터는 관찰되지 않는다. 녹색의 미생물 매트가 발달된 튜파 중 가장 안쪽에서 형성된 BN-M4 시료에서 미생물 구조가 가장 다양하게 나타나는 결과를 보인다(그림 7). BN-M5부터는 필라멘트 형태의 미생물 구조가 거의 관찰되지 않으며, 일부 구균체 구조만이 관찰된다(그림 7). 구균들은 BN-M6의 이질퇴적물 엽층과 BN-M7의 미생물 매트에서는 군집 형태로 우세하게 관찰되나, BN-M8에서는 독립된 형태로 매우 드물게 관찰된다(그림 7).
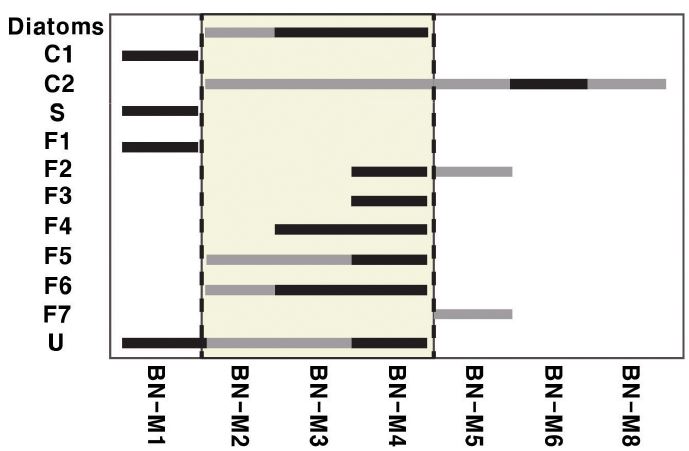
Changes in the diversity of microbial structures. There are two threshold areas indicated by two dashed lines. A threshold location is located between BN-M1 and BN-M2. Another is occurred between BN-M4 and BN-5. BN-M4 shows a highest diversity in microbial structures. The horizontal bars in this graph illustrate the occurrence of each microbial texture (black = present, gray = dominant).
4. 토 의
동굴환경에서 탄산염암을 형성시키는 물리화학적 작용들 중 가장 중요한 요인은 토양대를 통과하여 공급된 동굴수(cave water)로부터 이산화탄소가 유리되는 작용이다(Ford and willams 1989; Gordon et al., 1989). 이외에도 국지적으로 건조한 공기의 지속적인 흐름으로 인해 발생하는 증발작용(Harmon et al., 1983), 석회질 성분의 우세한 공급(Atkinson, 1983) 등이 보고된 바 있다. 하지만 최근 일부 미생물의 활동이 동굴생성물 내지 동굴 입구부의 튜파 형성에 기여하고 있음이 속속 보고되고 있다(Jones, 2010; Tisato et al., 2015). 이러한 미생물의 작용은 다양한 염기서열분석법과 미생물 배양 등을 통해 증명되기도 하였다(Cacchio et al., 2004; Banks et al., 2010; Tisato et al., 2015). 튜파 등 민물 탄산염암 표면에 형성된 미생물 매트는 미생물과 광물 사이의 상호작용을 연구하는데 중요한 정보를 제공해주는데(Krumbein et al., 2003), Pedley and Rogerson (2010)은 미생물 매트의 산출 형태와 튜파의 구조가 매우 밀접하게 관련되어 있다고 언급하였다. Taborosi et al. (2005)은 동굴 입구부에서 형성된 튜파의 경우 그 형성을 위해 미생물의 작용이 매우 중요하다고 보고하였다.
박편 상에서 관찰되는 직경 1-5 ㎛의 미크라이트로 구성된 필라멘트 조직은 주로 남세균(cyanobacteria) 또는 균류(fungi)의 균사체로 해석되고 있다(Arp et al., 1999b; Pedleyl, 2009; Perri et al., 2012; Bindschedler et al., 2010). 남세균은 광합성(photosynthesis)을 통해 탄산염 각을 형성하는 것으로 알려져 있으며, 이러한 껍질은 미크라이트질 필라멘트를 형성한다고 연구된 바 있다(Arp et al., 1998, 1999a, 1999b; Dupraz et al., 2004; Dupraz and Visscher, 2005). 이번 백룡동굴 입구부에서 확인된 미생물 구조 F1의 경우, 남세균의 껍질형성에 의해 잔류된 탄산염 물질로 생각할 수 있으나, 연쇄체(hormogonia)를 구성하는 사상체(trichome) 구조가 없고 포자나 자낭으로 판단되는 구조가 주변에서 흔히 관찰되며 일부 균사체는 시료의 표면으로부터 내부로 구멍을 형성하면서 파고든 형태로 관찰되는 것으로 보아(그림 5b, 5c, 5f) 균류의 균사체일 가능성이 높은 것으로 판단된다. Burford et al. (2006)의 연구에 의해 석회암을 기저로 21일 동안 25℃의 환경에서 배양한 균류가 2차적인 탄산염 광물을 침전시키는 것이 실험적으로 재현된 바 있다. 하지만 이러한 균류의 탄산염 광물 침전작용이 이번 백룡동굴 입구부 튜파 형성에 기여했는지는 판단할 수는 없으며, 향후 추가 연구를 진행한다면 이를 확인할 수 있을 것이다.
이번 연구에 이용된 시료 중 미생물 구조가 가장 다양하고 우세하게 관찰되는 BN-M4에서는 마름모 형태의 방해석이 자주 관찰되는데, 이들은 F2, F3, F6과 매우 근접하여 나타난다. F3는 시료의 가장 표면부에서 필라멘트 군체를 형성하고 있는 양상으로 나타나며(그림 5l), F6는 주로 결정면을 연결하는 형태로 관찰된다(그림 6e, 6f, 6g). 또, F2은 방해석 결정면의 특정방향으로 배열된 상태로 관찰되기도 하고(그림 5j), 때때로 필라멘트들이 복잡하게 엉겨 붙은 형태로도 관찰된다(그림 5m, 5n). 이들은 모두 직경이 약 1 ㎛ 이하의 곤봉형으로 끝이 두툼한 형태를 보이고(그림 5j, 5n, 6f) 다양한 형태의 군체를 형성하는 것으로 보아 방선균류(actinomycetes)일 가능성이 있으나 명확한 구분은 어려운 상태이다. 이들은 모두 탄산염 광물의 표면을 덮는 형태로 발달되는데, 특히 미생물 구조 F2와 F3은 EPS (Extracellular Polymeric Substances) 및 유기질 기질(organic matrix)과 더불어 덩어리진 형태를 보이기도 하며(그림 5j, 5m, 6h) 이러한 응집체로 인해 구형의 탄산염 물질이 형성될 수 있음이 보고된 바 있다(Casanova et al., 1999; Castanier et al., 1999).
이번 연구결과를 통해 동굴 입구부에서 채취한 민물 탄산염암 시료들은 서로 다른 미생물 구조들을 포함하고 있음을 확인하였다. 특히, 동굴 입구 근처에서 성장한 시료들에서는 동굴 내부로 갈수록 미생물 구조의 다양성이 증가하다가 BN-M5부터 급격한 감소를 보였다(그림 7). 시료 채취 전 BN-M5의 표면에는 미생물 매트가 발달하지 않았음을 관찰하였으며, 추가 분석을 통해 규조류도 존재하지 않음을 확인하였다. 따라서 이러한 결과는 조류인 규조가 광합성을 수행하는 것이 불가능한 지점을 나타내며, 최소한의 햇빛도 도달하지 않는 환경조건을 반영하고 있는 것으로 해석할 수 있다. BN-M5부터 관찰되는 미생물 구조의 다양성이 크게 감소하였지만 동굴의 가장 내부에 위치한 BN-M8에서 미생물 구조가 전혀 관찰되지 않는 것은 아니다. 동굴의 영구암대에서도 월유 또는 곡석과 같이 미생물 조직이 우세하게 관찰되는 동생성물들이 최근 보고된 바 있는 것처럼(Cacchio et al., 2004; Baskar et al., 2006; Tisato et al., 2015) 흔히 생물생존 측면에서 극한환경으로 인식되는 동굴 내부에서도 미생물의 흔적을 찾을 수 있는데, BN-M8 내에서도 매우 드물지만 구균체 형태의 미생물 구조가 관찰된다.
열대지역의 동굴 입구부에서부터 내부까지의 미기후 변화에 따른 튜파 형성 작용이 Taborosi et al. (2005)에 의해 연구된 바 있으나 온대지역에서의 연구는 아직까지 진행된 바 없다. 현재까지의 연구 자료를 종합적으로 분석해보면 전체적으로는 동굴 외부에서부터 동굴 내부로 가면서 미생물 구조의 다양성이 감소하는 일반적인 특징을 보이지만, 동시에 미생물 구조 다양성 측면에서 뚜렷한 임계지점이 관찰되는 매우 흥미로운 결과를 얻을 수 있었다(그림 7). 각 시료에서 관찰된 미생물 구조의 다양성이 급격한 변화를 보이는 구역은 크게 두 지점으로 볼 수 있는데, 첫 번째로는 동굴 외부와 동굴 입구 사이 구역을 들 수 있다. 이 연구에서 활용한 동굴 외부 시료 BN-M1과 입구지점 시료 BN-M2에 영향을 미친 온도 및 조도 등 대부분의 환경요소는 매우 유사했을 것으로 볼 수 있다. 그러나 직간접적으로 동굴수의 공급이 지속적으로 이루어질 수 있는 동굴 입구 지점과는 달리 BN-M1은 물의 공급이 강수일에 제한되었을 것으로 추정할 수 있다. 하지만 동굴 외부에서는 규조가 전혀 관찰되지 않는 반면 동굴 입구에서는 규조가 관찰되는 것으로 볼 때, 영양성분 내지 미생물 성장에 필요한 유무기 물질의 공급과 같은 요인도 배제할 수 없으므로 이에 대한 명확한 해석을 위해서는 추가적인 연구가 필요하다. 두 번째로 시료번호 BN-M4와 BN-M5 지점 사이에서 관찰되는 미생물 구조 다양성의 급격한 감소는 조도와 밀접하게 연관되었을 가능성이 매우 높다. 그 이유는 다양성의 급격한 감소 지점이 녹색 미생물 매트 및 광합성 조류인 규조의 출현 한계 지점과 일치하고 있고, 실제 현장 조사에서 관찰한 햇빛 도달 한계와 매우 잘 일치하기 때문이다. 따라서 동굴 입구부에서의 높은 미생물 구조의 다양성은 광합성을 통해 생존하는 독립영양미생물군(autotrophs)의 활동에 뒤이은 종속영양미생물군(heterotrophs)의 활발한 성장에 기인하는 것으로 해석할 수 있으며, 동굴 입구부가 미생물 생장에 상대적으로 유리한 환경 조건을 제공하는 것으로 추정된다. 이와 같이 동굴 박명부 튜파에서 관찰되는 미생물 구조의 다양성 증가는 미생물의 종 다양성 및 활성도 증가를 암시할 가능성이 있으며, 보다 명확한 사실 확인을 위해 추후 동일한 동굴에서 조직적인 시료채취를 실시하여 연구가 진행될 필요가 있다. 특히, 시료 채취 위치별 미기후(온도, 습도, 조도)를 파악하고 메타지놈 등 분자생물학적 분석기법을 추가 적용한다면 특정 미생물종의 공간적 분포를 조사할 수 있고 이들이 튜파의 미세구조, 외부 형태, 성장률에 미치는 영향을 이해할 수 있을 것으로 기대된다.
5. 결 론
백룡동굴 입구로부터 내부로 순차적으로 채취한 튜파-동굴생성물 시료는 다양한 형태의 미생물 구조를 포함하고 있다. 이들 미생물 구조는 구균체 형태 2종과 필라멘트 형태 8종 등 총 10가지 유형으로 분류할 수 있으며, 이외에도 특이한 유기 구조가 다량 관찰된다. 이러한 미생물 구조는 주로 규조류, 균류, 방사균류 등으로 추정되나, 정확한 동정은 메타지놈 분석 등 분자생물학적 기법을 적용하는 등 추가적인 연구를 요한다. 전체적으로 미생물 구조의 다양성은 동굴 내부로 갈수록 감소하는 경향을 보이지만, 다양성이 급격히 증가 또는 감소하는 임계 지점이 존재함을 확인하였다. 특히, 두 임계 지점 사이에는 미생물 구조 다양성이 매우 높은 구역이 존재하는데, 이 구역에서 생존하는 각각의 미생물종들은 온습도는 물론, 조도, 물과 영양성분 공급 등 다양한 환경요소에 의해 조절 받는 것으로 해석된다. 이와 같은 환경요소들은 각 동굴의 지질학적, 지형학적, 미기후학적 요소에 의해 크게 좌우될 수 있기 때문에 각 동굴 별로 독특한 미생물 활동 구역이 형성될 수 있을 것으로 추정된다. 무엇보다도 이 연구의 결과는 동굴 입구 주변이 미생물 생존에 상대적으로 유리한 조건을 제공하고 있음을 암시하며, 입구 주변 지역의 연구를 추가적으로 진행한다면 미생물 매트-광물 간 상호작용에 관한 이해를 도울 수 있을 것으로 기대된다.
Acknowledgments
이 연구는 2017년 정부(미래창조과학부)의 재원으로 한국연구재단의 지원을 받아 수행된 기초연구사업(No. NRF-2015R1A4A1041105)과 한국연구재단(NRF)의 지원을 받아 수행된 신진연구자지원사업(장기적 한반도 온난화 평가를 위한 Eemian 간빙기 기후변화 복원(No. NRF- 2016R1C1B2016525))의 일환으로 작성되었다. 또한, 2015년도 강원대학교 대학회계 학술연구조성비로 연구하였다.
REFERENCES
-
Arp, G., Hofmann, J., and Reitner, J., (1998), Microbial fabric formation in spring mounds microbialites) of alkaline salt lakes in the Badain Jaran sand sea, PR China, Palaios, 13(6), p581-592.
[https://doi.org/10.2307/3515349]

-
Arp, G., Reimer, A., and Reitner, J., (1999a), Calcification in cyanobacterial biofilms of alkaline salt lakes, European Journal of Phycology, 34(4), p393-403.
[https://doi.org/10.1080/09670269910001736452]

- Arp, G., Thiel, V., Reimer, A., Michaelis, W., and Reitner, J., (1999b), Biofilm exopolymers control microbialite formation at thermal springs discharging into the alkaline Pyramid Lake, Nevada, USA, Sedimentary Geology, 126(1), p159-176.
-
Atkinson, T.C., (1983), Growth mechanisms of speleothems in castleguard cave, Columbia Icefields, Alberta, Canada, Arctic and Alpine Research, p523-536.
[https://doi.org/10.2307/1551238]

-
Banks, E.D., Taylor, N.M., Gulley, J., Lubbers, B.R., Giarrizzo, J.G., Bullen, H.A., and Barton, H.A., (2010), Bacterial calcium carbonate precipitation in cave environments: a function of calcium homeostasis, Geomicrobiology Journal, 27(5), p444-454.
[https://doi.org/10.1080/01490450903485136]

-
Bindschedler, S., Millière, L., Cailleau, G., Job, D., and Verrecchia, E.P., (2010), Calcitic nanofibres in soils and caves: a putative fungal contribution to carbonatogenesis, Geological Society, London, Special Publications, 336(1), p225-238.
[https://doi.org/10.1144/sp336.11]

-
Brasier, A.T., Rogerson, M.R., Mercedes-Martin, R., Vonhof, H.B., and Reijmer, J.J.G., (2015), A test of the biogenicity criteria established for microfossils and stromatolites on Quaternary tufa and speleothem materials formed in the “Twilight Zone” at Caerwys, UK, Astrobiology, 15(10), p883-900.
[https://doi.org/10.1089/ast.2015.1293]

-
Burford, E.P., Hillier, S., and Gadd, G.M., (2006), Biomineralization of fungal hyphae with calcite (CaCO3) and calcium oxalate mono-and dihydrate in carboniferous limestone microcosms, Geomicrobiology Journal, 23(8), p599-611.
[https://doi.org/10.1080/01490450600964375]

-
Cacchio, P., Contento, R., Ercole, C., Cappuccio, G., Martinez, M.P., and Lepidi, A., (2004), Involvement of microorganisms in the formation of carbonate speleothems in the Cervo Cave (L'Aquila-Italy), Geomicrobiology Journal, 21(8), p497-509.
[https://doi.org/10.1080/01490450490888109]

- Canaveras, J.C., Cuezva, S., Sanchez-Moral, S., Lario, J., Laiz, L., Gonzalez, J.M., and Saiz-Jimenez, C., (2006), On the origin of fiber calcite crystals in moonmilk deposits, Naturwissenschaften, 93(1), p27-32.
-
Casanova, J., Bodénan, F., Négrel, P., and Azaroual, M., (1999), Microbial control on the precipitation of modern ferrihydrite and carbonate deposits from the Cézallier hydrothermal springs Massif Central, France), Sedimentary Geology, 126(1), p125-145.
[https://doi.org/10.1016/s0037-0738(99)00036-6]

-
Castanier, S., Le Métayer-Levrel, G., and Perthuisot, J.P., (1999), Ca-carbonates precipitation and limestone genesis- the microbiogeologist point of view, Sedimentary Geology, 126(1), p9-23.
[https://doi.org/10.1016/s0037-0738(99)00028-7]

-
Cuezva, S., Fernandez-Cortes, A., Porca, E., Pašić, L., Jurado, V., Hernandez-Marine, M., and Saiz-Jimenez, C., (2012), The biogeochemical role of actinobacteria in Altamira cave, Spain, FEMS microbiology ecology, 81(1), p281-290.
[https://doi.org/10.1111/j.1574-6941.2012.01391.x]

-
Dreybrodt, W., (1982), A possible mechanism for growth of calcite speleothems without participation of biogenic carbon dioxide, Earth and Planetary Science Letters, 58(2), p293-299.
[https://doi.org/10.1016/0012-821x(82)90202-3]

-
Dupraz, C., Reid, R.P., Braissant, O., Decho, A.W., Norman, R.S., and Visscher, P.T., (2009), Processes of carbonate precipitation in modern microbial mats, Earth-Science Reviews, 96(3), p141-162.
[https://doi.org/10.1016/j.earscirev.2008.10.005]

-
Dupraz, C., and Visscher, P.T., (2005), Microbial lithification in marine stromatolites and hypersaline mats, Trends in microbiology, 13(9), p429-438.
[https://doi.org/10.1016/j.tim.2005.07.008]

-
Dupraz, C., Visscher, P.T., Baumgartner, L.K., and Reid, R.P., (2004), Microbe-mineral interactions: early carbonate precipitation in a hypersaline lake (Eleuthera Island, Bahamas), Sedimentology, 51(4), p745-765.
[https://doi.org/10.1111/j.1365-3091.2004.00649.x]

- Ford, D.C., and Williams, P.W., (1989), Karst geomorphology and hydrology, London, Unwin Hyman, p601.
- Franke, R.B., and Bazylinski, D.A., (2003), Biologically induced mineralization by bacteria, Mineralogical Society of America, Review in Mineralogy and Geochemistry, 54, p95-114.
-
Gordon, D., Smart, P.L., Ford, D.C., Andrews, J.N., Atkinson, T.C., Rowe, P.J., and Christopher, N.S.J., (1989), Dating of late Pleistocene interglacial and interstadial periods in the United Kingdom from speleothem growth frequency, Quaternary research, 31(1), p14-26.
[https://doi.org/10.1016/0033-5894(89)90082-3]

-
Harmon, R.S., Atkinson, T.C., and Atkinson, J.L., (1983), The mineralogy of Castleguard Cave, Columbia Icefields, Alberta, Canada, Arctic and Alpine Research, p503-516.
[https://doi.org/10.2307/1551236]

-
Jones, B., (2010), Speleothems in a wave-cut notch, Cayman Brac, British West Indies: the integrated product of subaerial precipitation, dissolution, and microbes, Sedimentary Geology, 232(1), p15-34.
[https://doi.org/10.1016/j.sedgeo.2010.09.003]

- Krumbein, W.E., Paterson, D.M., and Zavarzin, G.A., (2003), Fossil and recent biofilms: a natural history of the impact of life on planet Earth, Kluwer Scientific publishers, Dordrecht, The Netherlands, p482.
-
Manzo, E., Perri, E., and Tucker, M.E., (2012), Carbonate deposition in a fluvial tufa system: processes and products (Corvino Valley-southern Italy), Sedimentology, 59(2), p553-577.
[https://doi.org/10.1111/j.1365-3091.2011.01266.x]

-
Pedley, M., (2009), Tufas and travertines of the Mediterranean region: a testing ground for freshwater carbonate concepts and developments, Sedimentology, 56(1), p221-246.
[https://doi.org/10.1111/j.1365-3091.2008.01012.x]

- Pedley, H.M., and Rogerson, M., (2010), Introduction to tufas and speleothems, Geological Society of London ( Special Publications), 336(1), p1-5.
- Perri, E., Manzo, E., and Tucker, M.E., (2012), Multi-scale study of the role of the biofilm in the formation of minerals and fabrics in calcareous tufa, Sedimentary Geology, 263, p16-29.
-
Reitschuler, C., Spötl, C., Hofmann, K., Wagner, A.O., and Illmer, P., (2016), Archaeal distribution in moonmilk deposits from Alpine caves and their ecophysiological potential, Microbial ecology, 71(3), p686-699.
[https://doi.org/10.1007/s00248-015-0727-z]

- Taborosi, D., Hirakawa, K., and Sawagaki, T., (2005), Carbonate precipitation along a microclimatic gradient in a Thailand cave-continuum of calcareous tufa and speleothems, Journal of Cave and Karst Studies, 67(1), p69-87.
-
Tisato, N., Torriani, S.F., Monteux, S., Sauro, F., De Waele, J., Tavagna, M.L., and Bontognali, T.R., (2015), Microbial mediation of complex subterranean mineral structures, Scientific reports, 5, p15525.
[https://doi.org/10.1038/srep15525]

- Weiner, S., and Dove, P.M., (2003), An overview of biomineralization and the problem of the vital effect, Mineralogical Society of America, Review in Mineralogy and Geochemistry, 54, p1-31.
- Woo, K.S., Kim, R., Lee, K.C., Choi, Y.G., and Choi, D.W., (2006), Scientific investigation of the Baegnyong Cave, Pyeongchanggun, Gangwondo, Pyeongchanggun, Korea, p222, (in Korean).

